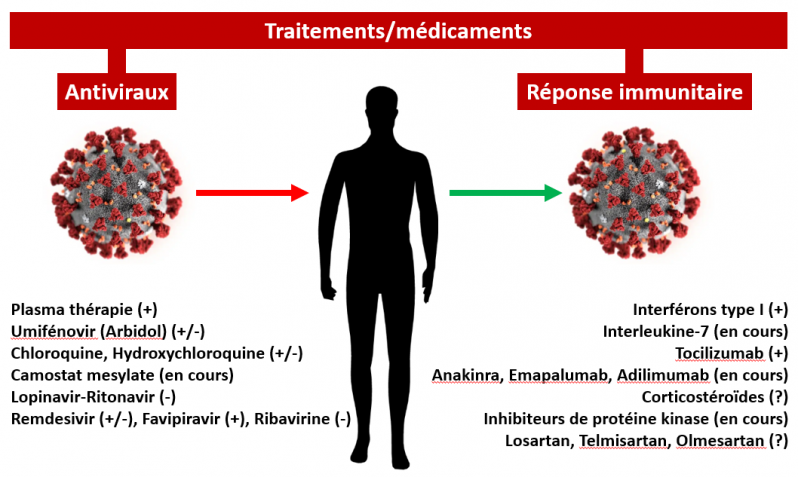
La course aux traitements
Résumé tout public
À ce jour, plus de 1000 études portant sur diverses stratégies thérapeutiques pour le traitement du COVID-19 sont en cours. Dans le cas d’une pandémie telle que celle que nous vivons actuellement, attendre l’arrivée de nouveaux médicaments spécifiques du SARS-CoV-2 serait totalement inacceptable au plan médical. En effet, la mise sur le marché d’un nouveau médicament nécessite des années de recherche et de développement. En conséquence, les efforts se concentrent sur la « réorientation » de l'utilisation de médicaments disponibles sur le marché et ayant prouvé leur efficacité sur d’autres infections virales : coronavirus (SARS-CoV et MERS-CoV), influenza (HxNy), SIDA, Ebola, hépatite C, etc., ou sur d’autres pathologies, avec des résultats qui sont loin d’être miraculeux.
Le COVID-19 résulte de l’atteinte du système respiratoire et d’autres organes comme le foie, le rein, l’intestin, le système nerveux central par le SARS-CoV-2. Cette atteinte active le système immunitaire inné qui chez certains malades entre dans une suractivation extrême conduisant à l’orage cytokinique pouvant entraîner la mort du fait d’une insuffisance respiratoire aigüe sévère (voir sur ce site ICI). Les médicaments visant à soigner ou prévenir le COVID-19 sont donc dirigés sur deux cibles : la réplication virale et la réponse immunitaire innée.
Traitements et médicaments les plus étudiés aujourd'hui (cette liste n'est pas exhaustive).
Signes: (+): effet bénéfique trouvé par toutes les études cliniques; (+/-): désaccords entre études, effets trouvés bénéfique ou pas; (-): accord entre les étude sur une absence d'effet bénéfique; ?: effet encore hypothétique. (en cours): études cliniques prometteuses encore en cours, mais sans résultats publiés.
Médicaments ou pratique qui inhibent la réplication virale
- Plasma thérapie : cette pratique déjà utilisée pour d’autres virus par le passé, consiste à perfuser le malade avec du plasma de personnes ayant été infectées puis ayant guéri et contenant un niveau suffisant d’anticorps neutralisants pour bloquer le virus avant son entré dans les cellules.
- Médicaments visant à bloquer l’entrée du virus dans les cellules
- Umifénovir ou Arbidol : antiviral à large spectre, bloquant une (ou plusieurs) voie(s) intracellulaire(s) utilisée(s) par les virus au cours de leur cycle infectieux.
- Chloroquine et hydroxychloroquine : médicaments initialement utilisés en tant qu’anti-paludéens.
- Camostat mesylate : médicaments initialement utilisé dans le traitement de la pancréatite chronique.
- Médicaments visant à bloquer les protéines virales indispensables à sa réplication
- L’association lopinavir-ritonavir, utilisée depuis les années 2000 comme inhibiteurs de la protéase du virus du SIDA.
- Remdesivir, Favipiravir et Ribavirine, initialement utilisés comme inhibiteurs de l’ARN polymérase virale de différents virus (Ebola et Influenza, notamment).
Médicaments qui modulent la réponse immunitaire innée et/ou inhibent l’orage cytokinique
- Cytokines qui activent la réponse immunitaire
- Interféron de type I (a et b), une cytokine qui induit la production des protéines antivirales de l’hôte, utilisé dans le traitement de l’hépatite C.
- Interleukine-7, une cytokine qui induit la production de lymphocytes T cytotoxiques, cellules de l’immunité cellulaire, dirigées contre divers agresseurs (virus, cellules cancéreuses, etc.) et utilisée dans le traitement du SIDA ou du choc septique.
- Anti-cytokines qui bloquent la suractivation (orage cytokinique) du système immunitaire
- Tocilizumab et Sarilumab, anticorps monoclonaux humanisés, bloquant l’interaction de l’interleukine-6 avec son récepteur et donc son action.
- Anakinra : un antagoniste recombinant du récepteur de l’interleukine-1 impliquée dans l’orage cytokinique.
- Adalimumab : un anticorps monoclonal bloquant l’action du TNF-alpha, une cytokine impliquée dans l’orage cytokinique.
- Emapalumab : un anticorps monoclonal anti-IFN-gamma, un interféron différent des interférons de type I et surexprimé lors de l’orage cytokinique.
- Corticostéroïdes, puissants inhibiteurs de cytokines et du système immunitaire dont l’usage dans la maladie de COVID-19 est débattu.
- Inhibiteurs de protéine kinase. Les protéines kinases sont des enzymes impliquées, entre autres fonctions, dans la mise en place de la réponse immunitaire innée et certaines peuvent participer à la survenue de l’orage cytokinique.
- tofacitinib, baricitinib, ruxolitinib et colchicine (essais cliniques en cours)
- Médicaments antagonistes de l’angiotensine 2
- Losartan, Telmisartan, Olmesartan, médicaments bloquant l’action de l’angiotensine 2 impliquée dans l’hypertension. Incertitude sur cette action dans le cadre de l’infection COVID-19. Le maintien du traitement avec ces molécules est recommandé chez les patients hypertendus.
Conclusion
Aucun de ces médicaments, excepté le remdesivir qui a reçu tout récemment une autorisation temporaire d’utilisation par la FDA, n’a encore reçu l’autorisation officielle des autorités sanitaires (EMA, FDA) pour une utilisation dans le cadre du traitement du COVID-19.
A l’instar de ce qui se pratique chez les malades atteints du SIDA ou de l’hépatite C, une polythérapie sera nécessaire, associant de façon coordonnée divers antiviraux (antiprotéase, anti ARN polymérase) et modulateurs de la réponse immunitaire (interféron, anti-cytokines, plasma thérapie, etc.).
Enfin, des désaccords sont fréquemment observés entre diverses études sur les effets bénéfiques ou non d’une même molécule. Le cas de l’hydroxychloroquine est à cet égard exemplaire. Mais on retrouve ces désaccords avec d’autres molécules (umifénovir, remdesivir, tocilizumab). Ces désaccords résultent vraisemblablement de diverses origines : médicaments inadaptés au SARS-CoV-2, essais cliniques non normalisés, nombre de malades insuffisant dans les cohortes, génétique des populations, associations avec d'autres traitements, malades traités à différents stades de la maladie, variants génomiques du SARS-CoV-2.
La course aux traitements
À ce jour, plus de 1000 études portant sur diverses stratégies thérapeutiques pour le traitement du COVID-19 sont en cours, incluant plus de 600 études interventionnelles et essais cliniques randomisés (Bauchner and Fontanarosa. JAMA 2020 ; Iyer et al. BMB Reports 2020 ; Esposito et al. Le Infezioni in Medicina 2020 ; Kupferschmidt and Cohen, Science 2020 ; Martinez. Antimicrob Agents Chemother 2020; Sanders et al. JAMA 2020 ; Jamilloux et al. Autoimmunity Reviews 2020). Au cours des prochaines semaines et mois, les résultats de nombre de ces essais seront publiés. Je ne manquerai pas de tenir ce site à jour sur ces résultats.
Il est évidemment impossible de présenter de façon exhaustive l’ensemble des études cliniques réalisées à ce jour sur la pandémie de COVID-19. Je me suis limité dans ce post à présenter les résultats d’études cliniques publiées essentiellement dans des revues scientifiques et médicales à comité de lecture et portant sur des malades dont le COVID-19 était confirmé par PCR; cependant, j’ai également considéré certaines études publiées sur les plateformes MedRxiv ou BioRxiv, outils de communication en mode accéléré avant décision des éditeurs, quand le cas me semblait nécessaire.
Dans ce problème de la course aux traitements, il faut bien comprendre que la mise sur le marché d’un nouveau médicament nécessite des années de recherche et de développement. Dans le cas d’une pandémie telle que celle que nous vivons actuellement, attendre l’arrivée de nouveaux médicaments spécifiques du SARS-CoV-2 serait totalement inacceptable au plan médical. Autrement dit, aucune stratégie thérapeutique spécifique n'est aujourd’hui (fin Mai 2020) approuvée pour le traitement de l'infection par le SARS-CoV2 par les diverses autorités de santé (EMA en Europe et FDA aux Etats-Unis, notamment). De fait, pour agir contre le SARS-CoV-2, les efforts se concentrent sur la « réorientation » de l'utilisation de médicaments disponibles sur le marché et ayant prouvé leur efficacité sur d’autres infections virales : coronavirus (SARS-CoV et MERS-CoV), influenza (HxNy), SIDA, Ebola, hépatite C, etc., ou sur d’autres pathologies.
Nous verrons que dans la plupart des cas, ces médicaments antiviraux ne donnent pas de résultats spectaculaires en termes d’efficacité et cela est bien normal. En effet, comme indiqué plus haut, ces médicaments ont été développés spécifiquement pour inhiber diverses protéines sur des virus (HIV, H1N1, HCV) différents du SARS-CoV2, et ils ne sont donc pas à même d’agir avec un maximum d’efficacité sur les protéines de ce virus. De plus, et pour plusieurs de ces médicaments, les études cliniques donnent des résultats souvent contradictoires (effet bénéfique versus pas d’effet).
Enfin, deux mots au sujet des essais cliniques.
Dans l’idéal, un essai clinique sur un médicament doit : i) comporter deux groupes : le groupe traité constitué de malades recevant le médicament à tester et le groupe contrôle ou placebo, ne recevant pas le médicament mais une formulation galénique identique ne contenant pas le principe actif, tout autre condition étant identique par ailleurs entre les deux groupes (notamment comédication s’il y en a) ; ii) être randomisé, c’est à dire que les malades doivent être répartis dans les deux groupes par tirage au sort ; iii) être conduit en double aveugle, les malades ne sachant pas à quel groupe ils appartiennent de même que les cliniciens ne savent pas quel traitement ils administrent (le médicament ou le placebo) à leurs malades. Ces diverses règles permettre de supprimer tout facteur humain susceptible d'influencer les résultats de l'essai.
Ce type d'essai est la seule procédure scientifiquement valide permettant de tirer des conclusions d'efficacité pour un médicament donné. Cependant, ce type d’essai n'est pas toujours possible à réaliser : i) organisation très complexe et chronophage ; ii) randomisation et utilisation de placebo parfois impossibles, notamment dans le cadre d’une épidémie particulièrement meurtrière pour laquelle les malades sont traités dans l’urgence.
Les différentes stratégies thérapeutiques
Le COVID-19 résulte de l’atteinte du système respiratoire et d’autres organes comme le foie, le rein, l’intestin, le système nerveux central par le SARS-CoV-2. Cette atteinte active le système immunitaire inné qui chez certains malades entre dans une suractivation extrême conduisant à l’orage cytokinique pouvant entraîner la mort du fait d’une insuffisance respiratoire aigüe sévère (voir sur ce site ICI). Les stratégies thérapeutiques visant à soigner ou prévenir le Covid-19 sont donc dirigées sur deux cibles : la réplication virale et la réponse immunitaire innée.
Réplication virale
Les virus sont constitués d’une enveloppe ou d’une capside au sein de laquelle est empaqueté leur génome, ADN ou ARN. Entrer dans les cellules leur est indispensable pour se multiplier car ils ne possèdent pas la capacité de synthétiser des protéines. Ils comblent cette lacune en détournant à leur profit la machinerie de synthèse des protéines des cellules qu’ils infectent.
Le cycle de réplication virale pour le SARS-CoV-2 comporte 6 étapes :
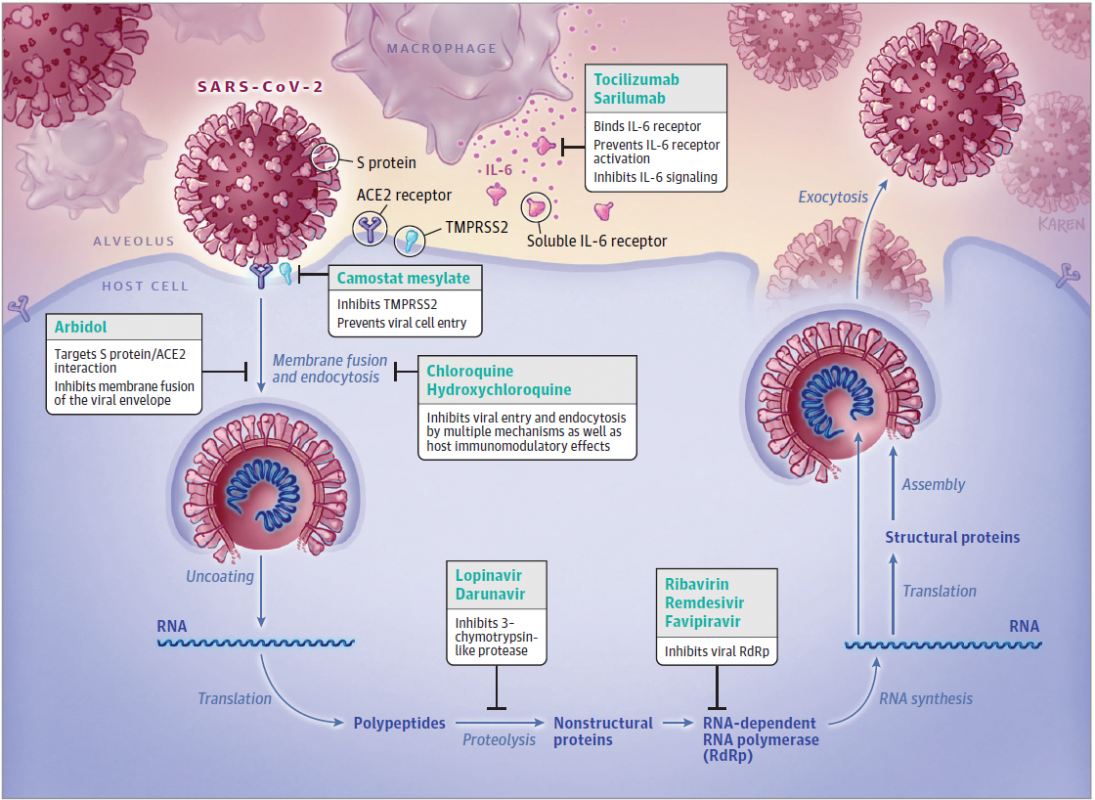
- Entrée du virus dans la cellule. Cette étape comporte plusieurs sous-étapes : fixation de la glycoprotéine S sur le récepteur, fusion avec la membrane de l’hôte, et libération du génome viral (ARN pour le SARS-CoV-2) dans la cellule.
- Synthèse de deux polyprotéines pp1a et pp1ab. Ces deux polyprotéines sont synthétisées par les ribosomes cellulaires à partir d’une majeure partie (2/3 environ) de l’ARN viral. Elles contiennent 16 protéines virales non structurales inactives (excepté les deux protéases, 3CLpro et PLpro). Ces polyprotéines doivent être clivées pour libérer les protéines virales.
- Clivage des polyprotéines et réplication de l’ARN viral. Les polyprotéines pp1a et pp1ab inactives sont clivées par deux protéases virales, la 3CLpro (protéase principale) et la PLpro. Ces clivages libèrent les diverses protéines virales non structurales actives. Elles vont former un complexe pour constituer l’ARN polymérase ARN-dépendante, enzyme clé qui synthétise le nouvel ARN viral en utilisant l’ARN antisens comme matrice.
- Synthèse des protéines virales structurales. Dans cette étape, les protéines structurales S (spike), E (enveloppe), M (membrane) et N (nucléocapside) qui vont constituer l’enveloppe du virus nouvellement formé sont synthétisées par les ribosomes cellulaires à partir de la partie restante (1/3 environ) de l’ARN viral. Plusieurs protéines accessoires non impliqués dans la réplication virale mais qui interfèrent avec la réponse immunitaire innée de l'hôte (ou dont la fonction est encore inconnue) sont également synthétisées à cette étape.
- Formation des virions. Les protéines non structurales réarrangent les membranes qui sont dérivées du réticulum endoplasmique en vésicules à l’intérieur desquelles la réplication virale et la transcription ont lieu. Une caractéristique unique des coronavirus est la fonction d'exoribonucléase de la protéine non structurale nsp14 dans la relecture et la correction de l’ARN néosynthétisé, évitant l'accumulation de mutations préjudiciables et conférant sa stabilité au génome viral. Les glycoprotéines d'enveloppe nouvellement formées sont insérées dans le réticulum endoplasmique ou les membranes de l’appareil de Golgi ; l’ARN génomique et la protéine N se combinent pour former les nucléocapsides, et les particules bourgeonnent dans le compartiment intermédiaire réticulum endoplasmique-appareil de Golgi.
- Libération des virions. Les vésicules contenant le virions fusionnent ensuite avec la membrane plasmique de la cellule pour libérer le virus dans le milieu extracellulaire. Les virus néosynthétisés peuvent infecter d’autres cellules de l’hôte.
Les stratégies thérapeutiques visant la réplication virale consistent donc à bloquer une ou plusieurs des étapes décrites ci-dessus.
Réponse immunitaire innée
La réponse immunitaire innée débute par la reconnaissance de l’agent infectieux qui conduit à l'activation d’un arsenal constitué d’interférons, de nombreuses protéines antivirales, de cytokines et chimiokines. Les cytokines et chimiokines agissent comme des messagers dont le but est de recruter sur le site de l’infection les cellules de l’immunité innée comme les macrophages, neutrophiles, cellules tueuses (T), et autres. Ces cellules éliminent le virus de façon directe en le détruisant ou indirecte en détruisant les cellules qui en sont infectées et le produisent.
Comme nous l’avons vu sur ce site, l’orage cytokinique résulte d’une surexpression de cytokines et chimiokines pro-inflammatoires qui conduit à la destruction des cellules infectées et non infectées constituant les alvéoles pulmonaires et les micro-vaisseaux afférents.
Les stratégies thérapeutiques visant la réponse immunitaire consistent donc à réguler l’expression ou l’action des cytokines ou chimiokines pro-inflammatoires impliquées dans ce processus afin d’éviter, au final, le déclenchement de l’orage cytokinique.
Les traitements visant la réplication virale du SARS-CoV-2
Inhibiteurs de l’entrée virale
Plasma thérapie
La plasma thérapie consiste à administrer au malade par voie intramusculaire (le plus souvent) du plasma dit « de convalescence » prélevé sur une personne ayant contracté le Covid-19 et ayant non seulement survécu et guéri mais surtout ayant développé des anticorps neutralisants contre le virus. Le résultat attendu de cette thérapie est que les anticorps neutralisants vont bloquer l’entrée du virus dans les cellules, réduire la charge virale, et améliorer l’état clinique du malade. Ce type de thérapie a déjà été appliqué avec des résultats encourageants depuis 2003 aux cas d’infections par des virus comme Ebola, SARS-CoV, MERS-CoV, H1N1 et H5N1. Une analyse réalisée sur 5 études (Kai et al. PNAS 2020 ; Shen et al. JAMA 2020 ; Zhang et al. Chest 2020 ; Ahn et al. J Korean Med Sci 2020 ; Ye et al. J Med Virol 2020) rapportant les résultats d’une plasma thérapie sur des malades du COVID-19, fait apparaître les résultats suivants : (i) réduction de la mortalité ; (ii) augmentation des titres d'anticorps neutralisants ; (iii) disparition de l’ARN du SARS-CoV-2 chez presque tous les patients après traitement ; (iv) effet bénéfique sur les symptômes cliniques (Rajendran et al. J Med Virol 2020). Cependant, dans une autre étude (Zeng et al. J Infect Dis 2020), 6 malades du COVID-19 souffrant d'insuffisance respiratoire sévère ont reçu une plasma thérapie à 21,5 jours après la première détection de l'excrétion virale. Tous ont été testés négatifs pour l'ARN du SARS-CoV-2 au plus tard 3 jours après, mais 5 d'entre eux sont décédés malgré tout, suggérant que le traitement devrait être initiée le plus tôt possible car il cible essentiellement le virus et non les complications hyper inflammatoires résultantes.
Dans une étude de recherche des effets indésirables de cette stratégie thérapeutique, Joyner et al. (MedRxiv 2020) ont analysé les principaux paramètres de sécurité après la transfusion de plasma humain COVID-19 de convalescence (compatible ABO) chez 5 000 adultes hospitalisés atteints de COVID-19 grave ou potentiellement mortel, dont 66 % dans des unités de soins intensifs, dans le cadre du programme d'accès élargi de la FDA américaine pour la plasma thérapie du COVID-19. L'incidence de tous les effets indésirables graves dans les quatre premières heures suivant la transfusion était de <1%, y compris le taux de mortalité (0,3%). Sur les 36 effets indésirables graves seulement 2 ont été jugés comme définitivement liés à la plasma thérapie. Le taux de mortalité sur 7 jours était de 14,9 %. Compte tenu de la nature mortelle du COVID-19 et de la grande population de patients gravement malades incluse dans ces analyses, le taux de mortalité ne semble pas excessif. En conclusion, ces premiers indicateurs suggèrent que la plasma thérapie est sûre chez les patients hospitalisés atteints de COVID-19.
Umifénovir
L'umifénovir (également connu sous le nom d'Arbidol) est un agent antiviral à large spectre, avec un mécanisme d'action unique ciblant les particules virales et/ou la cellule infectée, en bloquant une (ou plusieurs) voie(s) intracellulaire(s) utilisée(s) par les virus au cours de leur cycle infectieux (Pêcheur et Polyak, Médecine et Science Paris 2016). Dans le cas présent du SARS-CoV-2, l’umifénovir cible l'interaction entre la glycoprotéine S du virus et son récepteur ACE2 en inhibant la trimérisation de la glycoprotéine S essentielle à l'adhérence et à l’entrée du virus dans les cellules (Vankadari. Journal of Antimicrobial Aggents 2020). Ce médicament est actuellement approuvé en Russie et en Chine pour le traitement et la prophylaxie de la grippe (Influenza H1N1), et a montré une efficacité dans le traitement contre le virus de l’hépatite C et le virus Ebola. Son intérêt pour le traitement de COVID-19 est basé sur des données in vitro montrant un effet inhibiteur sur le SARS-CoV (Khamitov et al. Vopr Virusol 2008 ; article en Russe) et le SARS-CoV-2 (Wang et al. Cell Discov 2020).
Trois études cliniques sur des patients atteints de COVID-19 confirmés par PCR ont montré un effet bénéfique de l’umifénovir seul (Wang et al. Clin Infect Dis 2020 ; Zhu et al. Journal of Infection 2020) ou en association avec la combinaison lopinavir-ritonavir (Deng et al. Journal of Infection 2020) avec une baisse significative de la mortalité et/ou de la charge virale par rapport au groupe contrôle, sans effet secondaire. Cependant, une autre étude n’a pas montré d’effet significatif de l’umifénovir sur la charge virale des malades ne présentant pas d’insuffisance respiratoire sévère (Lian et al. Clin Microbiol Infect 2020).
Cet ensemble d’observations ne permet pas d'établir de façon univoque l'efficacité de l'umifénovir pour le traitement de COVID-19, mais d’autres essais cliniques randomisés sont en cours en Chine afin d'évaluer cet agent.
Chloroquine et Hydroxychloroquine
La chloroquine et l'hydroxychloroquine sont deux médicaments classiquement utilisés à l'origine pour traiter le paludisme/malaria (Savarino et al. Lancet Infect Dis 2006). Le 19 Février 2020 une étude clinique préliminaire chinoise suggérait que la chloroquine pourrait être efficace dans le traitement du COVID-19 (Gao et al. Bioscience Trends 2020). Cette étude se basait sur des observations montrant l'effet antiviral de la chloroquine in vitro sur des cellules humaines (Wang et al. Cell Res. 2020). Selon ces travaux et d’autres études antérieures, le mécanisme antiviral de la chloroquine résulterait de sa capacité à augmenter le pH à l'intérieur des endosomes, inhibant ainsi le processus de fusion membranaire indispensable pour permettre l'entrée du virus dans la cellule. Voir ce mécanisme sur ce site ICI.
Cette étude ainsi que celles réalisées dans le service du Professeur Didier Raoult à Marseille (Gautret et al. Int J Antimicrob Agents 2020) ont suscité un immense espoir pour le traitement de COVID-19. Cependant, divers éléments ne permettent pas aujourd'hui de conclure de façon univoque sur la capacité de l’hydroxychloroquine à guérir les malades du COVID-19 : i) problèmes dans le concept des essais cliniques (avec pour certains : nombre trop faible de malades testés, pas de bras « placebo », pas de bras « contrôle », pas d’essai randomisé, pas d’essai en double aveugle), ii) hétérogénéité des résultats avec des études montrant des effets bénéfiques pour les malades (Gao et al. Biosci Trends 2020 ; Gautret et al. Int J Antimicrob Agents 2020 ; Yu et al. MedRxiv 2020 ; Chen et al. MedRxiv 2020) versus des études ne montrant pas d’effet (Rosenberg et al. JAMA 2020 ; Geleris et al. NEJM 2020 ; Borba et al. JAMA 2020 ; Molina et al. Médecine et Maladies Infectieuses 2020 ; Chen et al. Journal of Zhejiang University 2020 ; Mehra et al. Lancet 2020 ; Tang et al. British Med J 2020 ; Mahévas et al. British Med J 2020), et iii) problèmes de toxicité cardiaque au cours du traitement évoqué dans certaines études (Naksuk et al. Europ Heart Journal 2020 ; Borba et al. JAMA 2020 ; Mehra et al. Lancet 2020).
Sur ce dernier point, il faut rappeler que la chloroquine et l’hydroxychloroquine sont utilisées depuis plus de cinquante ans pour le traitement du paludisme et de la polyarthrite rhumatoïde; et leurs effets cardio-toxiques sont également bien connus. Il faut rappeler aussi que, même en absence de traitement incluant la chloroquine ou l’hydroxychloroquine, le SARS-CoV-2 peut entraîner des troubles cardio-vasculaires sévères (Clerkin et al. Circulation 2020). Il faut donc rester prudent dans l’interprétation des résultats sur les effets secondaires cardio-vasculaires et tenter de faire la part des choses dans l’implication du virus et/ou des antipaludéens.
Enfin, pour rester totalement objectif, il est intéressant de mentionner l’étude de Meo et al. (European Review for Medical and Pharmacological Sciences 2020), qui montre une corrélation apparente entre COVID-19 et paludisme. En effet, l'épidémie de COVID-19 s'est largement étendue aux pays et continents qui sont exempts de paludisme, Chine, Italie, États-Unis, Espagne, Allemagne, France, Suisse, Royaume-Uni et Iran. En revanche, son incidence est très faible en Asie du Sud-Est (Vietnam, Cambodge), en Inde et dans les pays Africains (subsahariens) où le paludisme est endémique bien que dans la plupart de ces pays les infrastructures sanitaires soient fragiles. Une explication possible de cette situation pourrait résulter de l’utilisation fréquente dans ces pays de médicaments antipaludéens et notamment l'hydroxychloroquine et la chloroquine.
Sur la base de résultats publiés dans l'étude de Mehra et al. Lancet 2020, l'OMS a recommander de stopper les essais cliniques sur l'hydroxychloroquine dans le traitement du COVID-19. Décision reprise immédiatement par les autorités sanitaires françaises.
Science et politique
Il est regrettable que les tests cliniques réalisés sur ces deux molécules aient débouché sur de multiples débats scientifico-politiques ou politico-scientifiques dont, à mon humble avis, la qualité des argumetations des pour et des contre n'a pas toujours été à la hauteur de l'enjeu.
Camostat mesylate
L’entrée du virus dans les cellules se fait en plusieurs étapes : i) fixation de la glycoprotéine S sur le récepteur (ACE2), ii) clivage de la glycoprotéine S par la protéase cellulaire TMPRSS2 et iii) fusion avec la membrane de l’hôte, suivie de la libération du génome viral (ARN) dans la cellule (voir sur ce site ICI). La connaissance de ce mécanisme ouvre la voie à la mise en place d’une stratégie thérapeutique visant la protéase TMPRSS2 : en bloquant cette protéase on bloque l’entrée du virus dans les cellules. Le camostat mesylate (Ono-Pharmaceuticals Co., Japan), un médicament déjà approuvé et utilisé au Japon pour le traitement de pancréatites chroniques est un inhibiteur de l’activité biologique de la TMPRSS2 (Kawase et al. 2012 ; Zhou et al. 2015; Hoffmann et al. 2020). Ce médicament et certaines molécules apparentées (notamment le nafamostat mesylate) avec les mêmes effets thérapeutiques pourraient être utilisés pour le traitement des malades infectés par le SARS-CoV-2 (Uno, Internal and Emergency Medicine 2020).
Plusieurs essais cliniques randomisés sont en cours actuellement au Japon, au Danemark et aux Etats Unis. Les résultats ne sont pas encore connus.
Représentation schématique de la réplication virale dans les cellules infectées et de la réponse immunitaire innée (Sanders et al. JAMA 2020).
Inhibiteurs de protéase virale
Lopinavir et ritonavir
Les polyprotéines du SARS-CoV-2, pp1a et pp1ab sont inactives. Pour qu’elles puissent être activées elles doivent être clivées par deux protéases virales, la PLpro (papain-like protease, nsp3) et la 3CLpro (chymotrypsin-like protease, nsp5) contenues dans les deux polyprotéines. Ces clivages libèrent les 16 protéines virales non structurales (nsp1 à nsp16) actives qui vont pouvoir former un complexe pour constituer l’ARN polymérase ARN-dépendante, enzyme clé qui synthétise le nouvel ARN viral. La stratégie thérapeutique ici est donc de bloquer ces deux protéases PLpro et 3CLpro pour inhiber la réplication virale. Cette stratégie a déjà été utilisée avec succès depuis les années 2000 dans le traitement des malades infectés par le HIV (SIDA) avec deux molécules antiprotéase virale, le lopinavir et le ritonavir. Le ritonavir inhibe, de surcroit, le métabolisme hépatique du lopinavir (par blocage du cytochrome CYP3A4) permettant ainsi d’augmenter fortement sa durée de vie dans le sang et de prolonger son action antivirale. La combinaison du lopinavir-ritonavir s'est révélée efficace contre le SRAS-CoV et le MERS-CoV chez les patients et en culture tissulaire in vitro (Martinez, Antimicrobial Agents and Chemotherapy 2020). Il était donc pertinent de la tester sur le SARS-CoV-2.
Un essai randomisé, contrôlé et ouvert a été conduit sur 199 patients hospitalisés atteints du Covid-19 confirmé par PCR, présentant une saturation en oxygène (Sa02) de 94% ou moins et un rapport (PaO2) /FiO2) inférieure à 300 (Cao et al. New England Journal of Medicine 2020). Les patients du bras lopinavir-ritonavir (n=100) ont reçu 400 mg et 100 mg, respectivement, deux fois par jour pendant 14 jours, en plus des soins habituels, ou soins standard seul (groupe contrôle). Le principal critère d'évaluation était le temps nécessaire à l'amélioration clinique, défini comme le délai entre la randomisation et une amélioration de deux points sur une échelle de sept ou la sortie de l'hôpital. Le traitement lopinavir-ritonavir n'a conduit à aucune modification dans le délai de temps nécessaire pour une amélioration clinique. La mortalité à 28 jours était similaire dans le groupe lopinavir-ritonavir et dans le groupe contrôle. Les pourcentages des patients présentant un ARN viral détectable étaient similaires quel que soit le temps de l’analyse. Les effets indésirables gastro-intestinaux étaient plus fréquents dans le groupe lopinavir-ritonavir, mais les effets indésirables graves plus fréquents dans le groupe contrôle.
Un autre essai multicentrique prospectif, randomisé, contrôlé (Li et al. MedRxiv 2020) sur l’association lopinavir-ritonavir a donné les mêmes résultats décevants sans mise en évidence d’un quelconque effet bénéfique.
D’autres essais randomisés sont en cours aux Etats-Unis et en Europe.
Darunavir
Un autre inhibiteur de protéase virale d’intérêt est le darunavir qui présente une activité in vitro sur le SARS-CoV-2 (Dong et al. Drug Discov Ther 2020). Un essai clinique est en cours en Chine sur cette molécule.
Inhibiteurs de l’ARN polymérase ARN-dépendante virale
Remdesivir
Le remdesivir est un analogue nucléotidique montrant une forte activité antivirale contre Ebola et le virus de Nipah chez les primates non humains (Cao et al. Travel Medicine and Infectious Diseases 2020). Il s’agit d’une prodrogue dont le métabolisme cellulaire libère le composé actif, un analogue de l’adénosine triphosphate (ATP), qui entre et s'accumule dans les cellules, inhibe l’ARN polymérase ARN-dépendante virale et stoppe la réplication du virus. Les coronavirus possèdent une enzyme de "relecture" (exoribonucléase) qui corrige les erreurs dans la séquence d'ARN, limitant potentiellement les effets des analogues, mais le remdesivir est capable d'échapper à cette relecture (Ferner, British Medical Journal 2020).
Le remdesivir est un inhibiteur de la réplication des SARS-CoV et MERS-CoV in vitro, et dans un modèle murin d’infection par le MERS-CoV, cette molécule prévient l’hémorrhagie pulmonaire et réduit la charge virale. Il était donc important de tester son effet thérapeutique sur le SARS-CoV-2 (Sanders et al. JAMA 2020).
Après des résultats encourageants obtenus sur le premier malade américain (homme de 35 ans) infecté par le SARS-CoV-2 le 19 Janvier 2020 (Holshue et al. New England Journal of Medicine 2020), et sur 3 malades dans le cadre d’un essai clinique non randomisé non contrôlé (Kujawski et al. MedRxiv 2020), un premier essai clinique « compassionnel » sur le remdesivir a été conduit sur 61 malades dont l’infection par le SARS-CoV-2 était confirmée par PCR, et dont la saturation en oxygène était de 94 % ou moins (Grein et al. New England Journal of Medicine 2020). Ces patients ont été traités avec 200 mg de remdesivir administré en intra-veineux le premier jour, puis 100 mg par jour pendant les 9 jours suivants. Les données relatives à 8 d'entre eux n’ont pu être analysées (dont 7 patients sans données post-traitement et 1 avec un erreur de dosage). Sur les 53 patients dont les données ont pu être analysées, 22 se trouvaient aux États-Unis, 22 en Europe ou au Canada, et 9 au Japon. Au départ, 30 patients étaient sous ventilation mécanique et 4 étaient sous oxygénation par membrane extracorporelle (respirateur). Au cours du suivi (médian de 18 jours), 36 patients ont montré une amélioration en matière d'assistance respiratoire et 17 des 30 patients qui étaient sous ventilation mécanique ont été extubés. Vingt-cinq malades ont quitté l’hôpital et 7 sont décédés. La mortalité était de 18% (6 sur 34) parmi les malades placés sous respirateur et 5 % (1 sur 19) parmi ceux placés sous ventilation mécanique. Au total, une amélioration clinique a été observée chez 36 des 53 patients (68%).
Beigel et al. (NEJM2020) ont mené un essai randomisé en double aveugle, et contrôlé par placebo sur le remdesivir chez des adultes hospitalisés pour le Covid-19 et présentant des signes de troubles respiratoires du tractus inférieur (essai enregistré ACCT-1 ClinicalTrials.gov number, NCT04280705). Les malades ont été répartis de façon aléatoire dans deux groupes : groupe remdesivir (200 mg le premier jour, suivie de 100 mg par jour pendant 9 jours supplémentaires) et groupe placebo (pour une durée maximale de 10 jours). Le critère de jugement principal était le délai écoulé avant le rétablissement, défini par la capacité de sortir du milieu hospitalier. Au total, 1063 malades ont été randomisés. Les résultats préliminaires sur 1059 d’entre eux (538 affectés au groupe remdesivir et 521 au groupe placebo) ont montré que ceux qui ont reçu le remdesivir ont eu un temps de récupération médian de 11 jours contre 15 jours chez ceux qui ont reçu le placebo. La mortalité à 14 jours étaient de 7,1 % dans le groupe remdesivir et de 11,9 % dans le groupe placebo. Les événements indésirables graves ont été signalés pour 114 des 541 patients du groupe remdesivir (21,1 %) et 141 des 522 patients du groupe placebo (27,0 %). En conclusion, le remdesivir a été supérieur au placebo en termes de réduction du temps de récupération chez les malades atteints de Covid-19 sur les voies respiratoires inférieures.
Cependant, une étude chinoise a abouti à des résultats différents. Wang et al. (Lancet 2020) ont réalisé un essai multicentrique randomisé, en double aveugle et contrôlé par placebo dans dix hôpitaux de Hubei, en Chine (essai ClinicalTrials.gov, NCT04257656). Les patients éligibles étaient des adultes (âgés de ≥18 ans) admis à l'hôpital avec une infection par le SARS-CoV-2 confirmée par PCR, avec un intervalle de 12 jours ou moins entre l'apparition des symptômes et l'enrôlement, une saturation en oxygène de 94 % ou moins, un rapport (PaO2) /FiO2) de 300 mm Hg ou moins, et une pneumonie confirmée par CT-scan. Les malades ont été répartis au hasard selon un rapport de 2:1 : groupe remdesivir administré en intraveineux (200 mg le jour 1 suivi de 100 mg du 2e au 10e jour en perfusion quotidienne unique) ou groupe placebo avec une administration d’un même volume de perfusion placebo pendant 10 jours. Les patients ont été traités simultanément avec lopinavir-ritonavir, interféron et corticostéroïdes. Le critère d’évaluation principal était le temps nécessaire à l'amélioration clinique, défini comme le temps (en jours) entre la randomisation et la baisse de deux points sur une échelle ordinale de six points reflétant l'état clinique (de 1 = sortie à 6 = décès) ou sortie de l'hôpital. Entre le 6 février 2020 et le 12 mars 2020, 237 patients ont été recrutés et affectés au hasard à un traitement (158 pour le remdesivir et 79 pour le placebo). L'utilisation du remdesivir n'a pas été associée à une amélioration clinique supérieure à celle des malades du groupe placebo : la mortalité à 28 jours après randomisation était de 14 et 13%, respectivement, dans les groupes remdesivir et placebo. De même, le temps d'amélioration clinique ne montrait pas de différence entre les deux groupes. Des effets indésirables ont été signalés dans 102 (66 %) des malades du groupe remdesivir contre 50 (64%) de ceux du groupe placebo. Le remdesivir a dû être arrêté prématurément en raison d’effets secondaires chez 18 (12%) des malades ; dans le même temps, 4 (5%) malades étaient sortis du groupe placebo précocement. En conclusion, cette étude montre que chez des malades adultes atteints de COVID-19 sévère le remdesivir n'a pas apporté d’avantages cliniques statistiquement significatifs. Ces études montrent donc des résultats contradictoires.
Toutefois, Le remdesivir a reçu le feu vert de l'ANSM, de la EMA et de la FDA pour son utilisation dans le cadre d'une ATU (autorisation temporaire d'utilisation).
Au moins 23 études portant sur environ 23500 malades sont est actuellement en cours (Ferner, British Medical Journal 2020).
Favipiravir
Le favipiravir (ou Avigan) est comme le remdesivir une prodrogue dont la bioactivation par l'hypoxanthine guanine phosphoribosyltransferase (HGPRT) génère le favipiravir-ribofuranosyl-5'-triphosphate sa forme active, (Naesens et al. Mol Pharmacol 2013). Cette molécule est un inhibiteur de la RNA Polymérase RNA-dépendante du virus de l’Influenza A (Jin et al. Plos One 2013).
Il a été récemment montré que le favipiravir inhibe l'infection de cellules humaines Vero E6 (ATCC-1586) par le SRAS-CoV-2 (Wang et al. Cell Res 2020). En outre, d'autres études ont montré que cette molécule est efficace pour protéger les souris contre le virus Ebola (Oestereich et al. Antiviral Res 2014). Il était par conséquent pertinent d'évaluer l'efficacité et de cet agent antiviral dans le traitement du Covid-19.
Dans une premier étude, Cai et al. (Engineering 2020) ont examiné l’effet du favipiravir comparativement à celui de la combinaison lopinavir/ritonavir pour le traitement du Covid-19. Les malades atteints du Covid-19 (confirmé par PCR) ont été répartis en deux groupes, le groupe favipiravir (jour 1 : 1600 mg deux fois par jour ; jours 2-14 : 600 mg deux fois par jour) et le groupe « contrôle », lopinavir-ritonavir (jours 1-14 : 400 mg/100 mg deux fois par jour), les deux groupes recevant simultanément l’interféron-alpha par inhalation d'aérosol (5 millions U deux fois par jour). L’examen thoracique par tomographie par émission de positons, la clairance virale et les effets secondaires ont été comparées entre les deux groupes. Pour les 35 patients du groupe favipiravir et les 45 patients du groupe contrôle, toutes les caractéristiques de base étaient comparables. Un temps de clairance virale plus court a été constaté dans le groupe favipiravir par rapport au groupe contrôle avec un temps médian de 4 jours (2,5-9) contre 11 jours (8-13) (P < 0,001). Le groupe favipiravir a également montré une amélioration significative de l'imagerie thoracique par rapport au contrôle, avec une amélioration de 91% contre 62% (P = 0,004). En outre, moins d’effets secondaires ont été trouvés dans le bras favipiravir par rapport au contrôle. Dans cet essai contrôlé, le favipiravir a donc montré un meilleur effet thérapeutique que la combinaison lopinavir-ritonavir en termes de progression de la maladie et de clearance virale.
Un autre essai multicentrique prospectif, randomisé, contrôlé et ouvert impliquant des patients adultes atteints de Covid-19 (Chen et al. MedRxiv 2020) a été publié. Les 240 patients ont été randomisés : 120 patients recevant le favipiravir (116 évalués ; 1600mgx2/premier jour suivi de 600mgx2/jour), et 120 recevant l'Arbidol (120 évalués ; 200 mgx3/jour) considérés comme contrôles. Le taux de guérison clinique au jour 7, critère principal de l’essai (toux, fièvre, fréquence respiratoire, saturation en oxygène), ne différait pas de manière significative entre les deux groupes. Par contre le favipiravir diminuait de manière significative le temps de latence pour le soulagement de la pyrexie et de la toux. Les effets néfastes (acide urique sérique, système digestif) causés par le favipiravir étaient légers et faciles à gérer.
Ribavirine
La ribavirine, un analogue de la guanine, inhibe l'ARN polymérase RNA-dépendante. Son activité clinique dans le traitement de l’hépatite C et son activité in vitro contre d'autres coronavirus (SARS-CoV) en a fait un candidat potentiel pour le traitement du COVID-19. Cependant, cette activité est faible et une revue systématique de l'expérience clinique avec la ribavirine pour le traitement du SARS-CoV a révélé des résultats non concluants et une toxicité hématologique et hépatique (Sanders et al. JAMA 2020 ; Stockman et al. Plos Med 2006). De même dans le traitement du MERS-CoV, la ribavirine, généralement en combinaison avec des interférons, n'a démontré aucun effet bénéfique en clinique ou sur la clairance virale (Morra et al. Rev Med Virol 2018 ; Arabi et al. Clin Infect Dis 2019). Ces données suggèrent que cette molécule ne peut être utilisée pour le traitement de COVID-19.
Les traitements visant la réponse immunitaire innée
Cytokines
Interféron de type I
On sait que les coronavirus SARS-CoV-2, SARS-CoV et MERS-CoV ont la capacité d’inhiber la réponse antivirale liée à l’interféron de type I (IFN-I, IFN-a et IFN-b) en bloquant sa voie de signalisation. Rappelons que l’un des rôles de l’IFN-I est de stimuler l’expression d’un grand nombre de gènes codant pour des protéines antivirales (voir sur ce site ICI). Il est donc logique d’envisager de traiter les malades du COVID-19 avec de l’IFN-I, comme cela est déjà le cas pour les malades atteints du virus de l’hépatite C, et a été le cas des malades infectés par le SARS-CoV et le MERS-CoV (Jamilloux et al. Autoimmune Reviews 2020).
Dans une étude rétrospective, Zhou et al. (MedRxiv 2020) ont étudié 77 adultes atteints de COVID-19 confirmés en laboratoire, traités soit avec de l'IFN-α2b nébulisé (5 mU deux fois par jour), soit de l'umifénovir oral (200 mg trois fois par jour), soit une combinaison des deux. Les auteurs ont constaté que le traitement par IFN-α2b - avec ou sans umifénovir - a considérablement réduit la durée de présence du virus détectable dans les voies respiratoires supérieures et a réduit le niveau des marqueurs inflammatoires IL-6 et protéine CRP.
Dans une autre étude (Meng et al. MedRxiv 2020) l’effet de l’IFN-α1b en gouttes nasales a été évalué prospectivement pour prévenir l'infection par le SRAS-CoV-2 du personnel soignant. Dans ce but, 2944 membres du personnel soignant ont été répartis en deux groupes en fonction de leur exposition au coronavirus : un groupe à faible risque (n=2 415, qui recevaient 4-6 gouttes nasales d’IFN 4 fois par jour pendant 28 jours), un groupe à haut risque (IFN en gouttes nasales plus thymosine sous-cutanée-α1 chaque semaine). Un groupe contrôle (non traité par l’IFN) était constitué par des médecins dans les mêmes zones de la province de Hubei, en Chine. Aucun des soignants des deux groupes traités par IFN n’a été contaminé, alors que dans le même temps, plus de 2 000 nouveaux cas de COVID-19 étaient diagnostiqués parmi le personnel soignants du groupe contrôle.
Ces deux études suggèrent que l'IFN-I contribue efficacement au traitement curatif et prophylactique contre le COVID-19.
Interleukine-7
La lymphopénie est une des caractéristiques du COVID-19 qui pourrait-être responsable de l’orage cytokinique par défaut d’élimination du virus et des cellules infectées. Il est donc tentant de supposer que l'IL-7, principale cytokine favorisant la production des lymphocytes et éventuellement l'inversion de l'épuisement des cellules T, pourrait être utile pour restaurer l'activité du système immunitaire inné (Sportes et al. J Exp Med 2008).
L’interleukine-7 recombinante a été utilisée avec succès pour traiter l'épuisement des cellules T après un choc septique et pour restaurer les cellules T CD4+ chez les patients atteints du VIH (virus du SIDA) sans aucun signe de détérioration clinique ni d’augmentation des marqueurs pro-inflammatoires (TNF-α, IL-6, CRP) (Thiébaut et al. Clin Infect Dis 2016). Étonnamment, il n'y a pas encore d'essai enregistré pour évaluer cette stratégie prometteuse chez des malades du COVID-19 (Jamilloux et al. Autoimmune Reviews 2020).
Anti-cytokines
Les cytokines sont au cœur de la physiopathologie du COVID-19. Si certaines d'entre elles sont bénéfiques (interféron de type I, interleukine-7), d'autres apparaissent préjudiciable (interleukin-1β, -6, et TNF-α) en particulier dans le contexte de l’orage cytokinique.
Tocilizumab
On sait que la morbidité et la mortalité associées au COVID-19 sont plus élevées chez les personnes âgées et en particulier chez les personnes souffrant de comorbidités (diabète, hypertension, maladies cardiovasculaires, etc.). Ces personnes pourraient théoriquement inclure des patients atteints de désordres immunitaires et placés sous bloqueurs de cytokines, médicaments qui inhibent la fonction de molécules impliqués dans la défense de l'hôte contre les pathogènes. Étonnamment cependant, et jusqu’à présent, on n’observe pas d'augmentation du nombre de cas de SARS-CoV-2 chez ces patients. La question qui se pose est donc de savoir si ces patients représentent une groupe résistant à la maladie de COVID-19. L'analyse du profil des cytokines pro-inflammatoires caractérisant les cas les plus sévères de COVID-19 (orage cytokinique) suggère que ce pourrait être le cas (Monteleone et al. Lancet 2020).
L’IL-6 (interleukine-6) est une cytokine pro-inflammatoire constamment trouvée surexprimée dans le sérum des malades les plus sévèrement atteints du COVID-19. Cette cytokine exerce son action biologique en se liant à son récepteur cellulaire IL-6R. Cette liaison active diverses voies de signalisation (JAK, STAT, MAPK) conduisant à l’activation d’un grand nombre de gènes impliqués dans diverses maladies résultant de processus inflammatoires tels que diabète, athérosclérose, dépression, maladie d’Alzheimer, lupus érythémateux, myélome, cancers et arthrite rhumatoïde. Il était donc pertinent de développer des agents anti-IL-6 et le tocilizumab est le premier d’entre eux. Il s’agit d’un anticorps monoclonal humanisé, qui cible le récepteur de l’IL-6 (IL-6R), empêchant la liaison de l’IL-6 et inhibant ainsi son action.
Le tocilizumab est présent sur le marché depuis un peu plus de 10 ans et est essentiellement utilisé dans le traitement de l’arthrite rhumatoïde (Smolen et al. Lancet 2008) et en réponse à la libération massive de cytokines après injection de lymphocytes T-CAR (Le et al. Oncologist 2018). Devant la mise en évidence de l’orage cytokinique chez les malades du COVID-19 en phase d’insuffisance respiratoire sévère, et du fait que leur niveau d’IL-6 plasmidique est toujours très élevé, il était logique de tester l’effet thérapeutique du tocilizumab sur cette maladie.
Je ne décrirai ici en détail que l’étude Xu et al. (Proc. Natl. Acad. Sci. 2020), non randomisée, non contrôlée. Vingt et un patients COVID-19 diagnostiqués comme étant dans un état graves ou critique ont reçu du tocilizumab (treated with tocilizumab (première dose 4–8 mg/kg de poids corporel, puis 400-800 mg en administration intra-veineuse) en complément d'une thérapie standard (lopinavir-ritonavir, ribavirine, interféron, glucocorticoïdes) entre le 5 et le 14 février 2020. Les manifestations cliniques, la tomographie assistée par ordinateur (CT-scan) et les examens de laboratoire ont été analysés rétrospectivement. La fièvre est revenue à la normale le premier jour, et les autres symptômes se sont remarquablement améliorés en quelques jours. Dans les 5 jours suivant l’administration de tocilizumab, 15 des 20 patients (75,0%) avaient diminué leur taux d'oxygène et un patient n'a plus eu besoin d'oxygénothérapie. Les scanners ont montré que les lésions pulmonaires étaient résorbées chez 19 patients (90.5%). Le pourcentage de lymphocytes dans le sang périphérique, qui était diminué chez 85,0 % des patients (17/20) avant le traitement (moyenne, 15,52 ± 8,89 %), est revenue à la normale chez 52,6 % des patients (10/19) le cinquième jour après le traitement. La protéine C-réactive qui était anormalement élevée avant traitement a diminué de manière significative chez 84,2 % des patients (16/19). Aucun effet indésirable n’a été observé. Tous les patients ont quitté l’hôpital en moyenne 15,1 jours après avoir reçu le tocilizumab. Ces données préliminaires montrent que le tocilizumab, est efficace pour réduire la mortalité dans les cas graves et critiques de COVID-19. De nombreux autres études cliniques (dont 3 françaises) ont été conduites avec des résultats similaires et encourageants (Luo et al. J Med Virol 2020; Michot et al. Annals of Oncology 2020; de Luna et al. Am J Hematology 2020; di Giambenedetto et al. 2020; Toniati et al. Autoimmun Rev 2020; Alzgari et al. J Clin Virol 2020; Roumieux et al. MedRxiv 2020; Klopfenstein et al. Med Mal Infect 2020; Alattar et al. J Med Virol 2020; van Kraaij et al. Eur J Case Rep Intern Med 2020; Capra et al. Eur J Intern Med 2020; Colaneri et al. Microorg 2020). A ce jour, une seule étude montrant une absence d’effet du tocilizumab chez des malades du COVID-19 a été publiée (Mazzitelli et al. J Med Virol 2020).
Sarilumab
Le sarilumab est un autre anticorps monoclonal dirigé contre le IL-6R. Des essais cliniques testant cet anticorps sont actuellement en cours.
Autres anti-cytokines
Anakinra (antagoniste recombinant de l’IL-1R), Emapalumab (anticorps monoclonal anti-IFN-gamma), adalimumab (anticorps monoclonal anti-TNF-alpha) : pas d’étude clinique publiée, mais des essais en cours sur COVID-19.
Corticostéroïdes
Les corticostéroïdes sont de puissants inhibiteurs de cytokines et du système immunitaire (immunosuppresseurs). Ils agissent par plusieurs mécanismes mais principalement en inhibant le facteur de transcription NF-κB. Ils constituent un traitement de choix pour maladies auto-immunes et/ou auto-inflammatoires. Il semblait donc logique de les utiliser dans les cas sévères de COVID-19. Toutefois, leur utilisation dans la prise en charge de cette maladie est actuellement très contestée (Russell et al. Lancet 2020 ; Shang et al. Lancet 2020). En effet, un examen systématique des études d'observation sur les corticostéroïdes administrés à des patients infectés par le SARS-CoV n'ont fait état d'aucun avantage en termes de survie (Stockman et al. Plos Med 2006). En outre, une étude portant sur des patients ayant reçu des corticostéroïdes pour une infection par le MERS-CoV a révélé un retard de la clairance du virus et pas d’effet des corticostéroïdes sur la mortalité (Arabi et al. Am J Respir Crit Care Med 2018). De même, un examen systématique des études d'observation de la grippe (Influenza) a constaté un risque plus élevé de mortalité et d'infections secondaires avec les corticostéroïdes à forte dose (Lansbury et al. Crit Care Med 2020). Dans l'ensemble, les corticostéroïdes peuvent donc être plus nuisibles que bénéfiques dans le traitement du COVID-19 et l'OMS recommande qu'ils ne soient pas utilisés en dehors des essais cliniques.
Inhibiteurs de protéine kinases
Les protéines kinases sont des enzymes qui catalysent une réaction dite de phosphorylation par transfert d'un groupe phosphate de l'adénosine triphosphate (ATP) sur un groupement hydroxyle (groupe-OH) d’une chaîne latérale d’un acide aminé d’une protéine cible possédant une fonction alcool, comme la sérine, la thréonine et la tyrosine. La protéine phosphorylée acquiert de nouvelles fonctions. La connaissance du génome humain montre qu’il contient environ 520 protéines kinases, codées par environ 2% des gènes, constituant le « kinome ». Les protéines kinases sont les médiateurs de la plupart des signaux transduction dans les cellules eucaryotes ; par modification de l'activité des protéines qu’elles phosphorylent, les protéines kinases aussi contrôlent de nombreux autres processus cellulaires, métabolisme, transcription, progression du cycle cellulaire, apoptose et différenciation. Les mutations et dysrégulation des protéines kinases jouent un rôle causal dans les maladies humaines, offrant la possibilité de développer des agonistes et des antagonistes de ces enzymes pour le traitement des maladies (Manning et al. Science 2002).
Dans le cadre d’une infection virale, la mise en place de la réponse immunitaire innée se fait en aval de voies de signalisation impliquant des protéines kinases, en particulier (mais non seulement) la voie JAK-STAT (voir sur ce site ICI). Divers essais clinique sur des inhibiteurs de la kinase JAK, tofacitinib, baricitinib, ruxolitinib et colchicine sont actuellement en cours (Jamilloux et al. Autoimmune Reviews 2020).
Les antagonistes de ATR1 : Losartan, telmisartan, olmesartan
Le SRAS-CoV-2 utilise le récepteur ACE2 pour pénétrer dans la cellule hôte (voir sur ce site ICI). Cette découverte a stimulé les discussions sur la question de savoir si les antagonistes du récepteur de l'angiotensine 2 (ATR1) peuvent potentiellement traiter le COVID-19 ou, à l'inverse, risquent d’aggraver la maladie. En effet, ces médicaments induisent l’expression de ACE2, ce qui pourrait théoriquement conduire à une aggravation de la maladie si l'entrée du virus est augmentée. En revanche, ils bloquent l’effet de l'angiotensine 2 dont la concentration est augmentée du fait de l’infection virale (par diminution de l’expression de ACE2) et pourraient théoriquement apporter un bénéfice clinique. Les données in vitro sur cette question sont contradictoires et ne permettent pas de savoir quel est l’effet (nocif ou protecteur) des antagonistes de ATR1 qui va prédominer au final chez les malades de COVID-19. En attendant de nouvelles recherches, les sociétés cliniques et les directives de pratique recommandent la poursuite de la thérapie pour les patients qui prennent déjà un de ces agents (Sanders et al. JAMA 2020 ; Gurwitz, Drug Dev Res 2020 ; Patel and Verma, JAMA 2020).
Conclusion
La pandémie de COVID-19 a entraîné une course aux traitements ciblant essentiellement d’une part la réplication virale et d’autre part le contrôle de la réponse immunitaire innée. Les médicaments antiviraux utilisés aujourd’hui ont été développés pour le traitement d’infections virales dues à des virus autres que le SARS-CoV-2 (Influenza, HIV, HCV ou autres). Ces médicaments ne peuvent donc présenter une efficacité importante puisqu’ils ciblent des protéines virales (protéases, ARN polymérases ARN-dépendantes) de séquences différentes de celles du SARS-CoV-2. Par exemple, le lopinavir ou le ritonavir ont été développés pour inhiber la protéase du HIV-1. Cette protéine n’est pas proche des protéases du SARS-CoV-2 en termes de séquence d’acides aminés et, de fait, la combinaison lopinavir-ritonavir n’a pas montré d’effets bénéfiques sur le COVID-19.
Aucun des médicaments considérés dans ce post, excepté le remdesivir (qui a tout récemment reçu une autorisation temporaire d’utilisation par la FDA), n’a encore reçu l’autorisation officielle des autorités sanitaires (EMA, FDA) pour une utilisation dans le cadre du traitement du COVID-19. Ces divers médicaments sont donc utilisés dans le cadre d’une « réorientation » de leur utilisation pharmacologique, et uniquement utilisés en essais cliniques. L’exemple de la chloroquine ou de l’hydroxychloroquine, médicaments antipaludéens, est typique à cet égard.
D’autre part, la maladie est clairement polyphasique avec une prolifération virale qui, chez certains malades, aboutit à l’orage cytokinique et au SARS (syndrome respiratoire aigu sévère). L’analyse de nombreuses études cliniques montre que les traitements doivent être mis en place de façon coordonnée en fonction de l’avancement de la maladie, ce qui n’est pas toujours le cas au moment de la prise en charge des malades. Dans les tout premiers stades de la maladie, le traitement doit se concentrer sur la réduction de la charge virale, soit par utilisation d’antiviraux, soit par stimulation de l'IFN de type I. Par la suite, chez certains patients, les thérapies ciblant les cytokines pro-inflammatoires pourrait atténuer l'hyper-inflammation, tandis que certaines cytokines (IL-7) pourraient théoriquement déclencher une restauration immunitaire. En pratique clinique, il est malheureusement rare que les patients soient détectés suffisamment tôt (c'est-à-dire avant, ou au moment, de l'apparition des symptômes) pour bénéficier au mieux de stratégies antivirales coordonnées. Autrement dit, la mise en place des stratégies thérapeutiques visant les cytokines pro-inflammatoires arrive souvent trop tard, quand le virus a eu le temps de proliférer de façon excessive et d’enclencher le processus d’orage cytokinique souvent fatal.
Par ailleurs et à l'instar de ce qui se pratique chez les malades atteints du SIDA ou de l’hépatite C, une polythérapie sera nécessaire, associant de façon coordonnée divers antiviraux (antiprotéase, anti ANR polymérase) et modulateurs de la réponse immunitaire (interféron, anti-cytokines, plasma thérapie, etc.).
Enfin, un point particulièrement préoccupant concerne les désaccords fréquents observés entre diverses études sur les effets bénéfiques ou non d’une même molécule. Le cas de l’hydroxychloroquine est à cet égard exemplaire. Mais on retrouve ces désaccords avec d’autres molécules (umifénovir, remdesivir, tocilizumab). Dans la mesure où l’objectivité scientifique et médicale des équipes cliniques ne saurait être mise en doute, voici quelques éléments qui pourraient contribuer à ces désaccords :
- Les molécules antivirales ont le plus souvent été développées spécifiquement pour d’autres virus et ne sont donc pas adaptées au SARS-CoV-2. Il faut donc s’attendre au mieux à des effets thérapeutiques modérés. C’est le cas par exemple du lopinavir spécifique de la protéase du HIV-1 qui semble inefficace pour le SARS-CoV-2.
- La majorité des études analysées ici n’ont pas été conduites selon la norme (essais contrôlés, randomisés et en double aveugle) du fait des situations d’urgence souvent extrêmes dans lesquelles elles ont été entreprises.
- Pour environ 90% des malades, cette pathologie évolue favorablement. Il faudrait donc des cohortes de milliers de patients pour que la puissance statistique des essais soit suffisante afin de conclure de façon univoque sur l’efficacité ou la non-efficacité d’un traitement.
- Il existe souvent une hétérogénéité de population dans les cohortes de malades traités (caucasiens, asiatiques, africains, hispaniques, etc.). Il est clair que les aspects génétiques propres à l’hôte (au malade) influent sur l’infection elle-même et sur la réponse du malade au traitement. Un exemple, pour ne prendre que celui-là, est l’influence des groupes sanguins ABO, le risque de contracter le virus SARS-CoV-2 étant plus grand pour les personnes du groupe A par rapport à celles du groupe O.
- Dans toutes les études cliniques, la molécule dont on voulait étudier les effets n’était pas la seule utilisée pour traiter les malades. De fait, elle se retrouvait en association avec plusieurs autres. Et d’une étude à l’autre, ces associations n’étaient pas toujours les mêmes. De même, d’un malade à l’autre dans une même cohorte les médicaments associés n’étaient pas toujours les mêmes. Or on sait que les associations entre médicaments peuvent influencer de façon importante leur pharmacodynamique (effet thérapeutique) et leur pharmacocinétique (niveau sanguin permettant d’assurer l’effet thérapeutique).
- La maladie de COVID-19 est polyphasique. Les études cliniques ne portaient pas toujours sur des malades se trouvant dans la même phase de la maladie, certains étant atteints de troubles légers (avant la phase hyper inflammatoire), d’autres étant en situation critique (orage cytokinique) pour ne prendre que ces deux extrêmes. Tout un spectre de situations intermédiaires entre ces deux extrêmes étant évidemment possible.
- Même si on admet que le génome du SARS-CoV-2 ne présente pas une capacité élevée de mutations, il est possible que dans une même cohorte, les malades puissent être porteurs de variants génomiques viraux différents pouvant provoquer des troubles d’ampleur différente et réagir différemment aux traitements.
- Enfin, la combinaison de ces divers éléments peut se révéler d’autant plus perturbante sur les résultats de diverses études cliniques que le nombre des malades dans les cohortes est généralement limité.
Date de dernière mise à jour : 18/07/2020
Commentaires
-

- 1. Arquilliere Anne Marie Le 30/05/2020
Merci -

- 2. Cathy Lebas Le 29/05/2020
Merci pour ce site pédagogique. Même si je ne saisis pas tout, loin de là, je perçois au moins la complexité ... et l’objectivité de l’exposé, ce qu’il est de plus en plus rare à trouver.
Bravo.
Ajouter un commentaire