Séroconversion
Séroconversion et tests sérologiques
Résumé tout public
A ce jour la détection du SARS-CoV-2 responsable de la pandémie de Covid-19 est essentiellement faite par RT-PCR (Réaction en Chaîne par Polymérase en Temps Réel), une méthode de biologie moléculaire qui permet de quantifier le génome viral. Bien que très sensible, cette méthode n'est satisfaisante que dans environ 70% des cas pour divers types de raisons. Il convient donc de mettre en place des tests sérologiques plus sensibles et fiables, basés sur la présence d'anticorps dans le sang des personnes qui ont été infectées.
Ces tests sont en cours d'évaluation par les agences sanitaires depuis début Avril. Leur mise au point nécessite de savoir le plus précisément possible comment les divers anticorps anti-SARS-CoV-2 sont générés chez les malades au cours de l'infection. Trois articles médico-scientifiques chinois font le point et apportent des précisions sur ce sujet.
La cinétique d’apparition des anticorps est similaire dans les trois études et montre une phase de montée située entre les jours 5 et 15 de l’infection avec maintien sur un plateau atteint environ un mois après l’infection. Des études de plus longue durée seront nécessaires afin de savoir si l’immunité est maintenue au-delà d’un mois et, si oui, pour quelle durée.
Réponse immunitaire chez les malades du Covid-19
L’infection par le SARS-CoV-2 conduit à la maladie appelée Covid-19 qui peut prendre diverses formes : légères dans 81% des cas (nez bouché, écoulement nasal), plus sérieuses dans 14% des cas (fièvre, difficultés à respirer et hypoxémie, fatigue) et très sévères dans 5% des cas (détresse respiratoire aigüe et/ou insuffisances cardiaque et/ou rénale) nécessitant une admission en unité de soins intensifs. Approximativement 3,4% des malades connaissent une issue fatale. A cela il faut ajouter les personnes asymptomatiques qui peuvent contribuer également à la transmission du virus. Poser un diagnostic rapide et fiable du Covid-19 permettrait d’une part le contrôle de la pandémie (placement en quarantaine par exemple), et d’autre part aiderait à la nécessaire sortie de confinement des malades ayant développé une séroconversion (production d’anticorps).
À ce jour, le diagnostic de l'infection par le SARS-CoV-2 est basé sur la détection et la quantification du génome viral par RT-PCR (Real Time-Polymerase Chain Reaction). Cependant, même si la sensibilité analytique de cette technique est élevée, ses performances réelles ne sont pas satisfaisantes avec une sensibilité de l’ordre de seulement 70%. Cela signifie que 30% des personnes infectées peuvent être laissées « dans la nature » avec pour conséquence, d’une part, la dissémination du virus et d’autre part, une prise en charge trop tardive de leur maladie. De plus, il est fréquent que les prélèvements nasopharyngés ne permettent pas de détecter le virus s’il est présent dans les voies respiratoires basses (trachée, bronches). Certes, dans les cas suspects, l’imagerie par tomodensitométrie pulmonaire peut fournir des éléments supplémentaires et objectifs de réponse, mais les anomalies révélées par cette technique ne sont pas toujours suffisantes pour conclure de façon univoque. Ces problèmes font du diagnostic de l'infection par le SARS-CoV-2 un goulet d'étranglement dans le choix des mesures pertinentes à mettre en place afin de limiter la pandémie actuelle.
Des tests diagnostiques complémentaires à la RT-PCR et à la tomodensitométrie seraient donc les bienvenus et c’est là que les tests permettant le dosage des anticorps sériques pourraient trouver leur place. Ces tests présentent certains avantages : rapidité et facilité du prélèvement (une goutte de sang), sensibilité supérieure, mais aussi moindre sollicitation des intervenants en temps et en énergie. Cependant le lancement de ces tests nécessite de connaître la réponse immunitaire de l’hôte en réaction au SARS-CoV-2, notamment en termes de cinétique et de quantité des anticorps produits. Ces données fondamentales font actuellement défaut du fait du caractère émergent de l’agent pathogène.
Trois études chinoises publiées tout récemment apportent des éléments intéressants dans ce domaine.
Première étude
Zhao et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019. Clinical Infectious Diseases 2020
Cette étude a porté sur 173 malades (âge moyen 48 ans et 51,4% de femmes) admis dans l’Hôpital du Peuple de Shenzhen (Shenzhen Third People’s Hospital) avant le 9 Février 2020 pour une infection par le SARS-CoV-2 confirmée par RT-PCR. Au total, 535 prélèvements de plasma ont été effectués afin de déterminer les taux des anticorps totaux, des IgG et des IgM par ELISA (Enzyme-Linked ImmunoSorbent Assay), le domaine de liaison au récepteur (RBD) de la protéine virale S étant utilisé comme antigène capteur. Cent seize de ces malades (67%) avaient voyagé ou séjourné à Wuhan. Parmi eux, 32 (18,5 %) avaient nécessité un passage en unité de soins intensifs. Le 19 février, 62 malades (35,8 %) étaient guéris et sortaient de l'hôpital et 2 d’entre eux (1,1 %) étaient décédés.
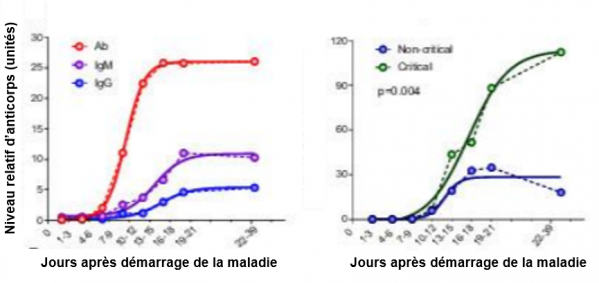
Niveau moyen des anticorps totaux (Ab), des IgM et IgG
anti-SARS-CoV-2 chez les malades.
Gauche: Comparaison des niveaux moyen des trois types d’anticorps en fonction du temps après démarrage de l’infection. Droite: niveau relative des anticorps totaux chez des malades développant des symptômes légers (Non-critical) et des malades développant des symptômes sévères (Critical), (selon Zhao et al.).
Le taux de séroconversion a été en moyenne de 93,1 % pour les anticorps totaux, 82,7 % pour les IgM et 64,7 % pour les IgG. Rappelons que les IgM constituent la première classe d’anticorps générés lors d’une infection et qu’ils sont soient secrétés dans le sang soient exprimés sur la membrane des lymphocytes B, et que les IgG sont secrétés dans le sang par les lymphocytes B et constituent environ 80% des anticorps totaux. Le temps médian de séroconversion était de 11 jours pour les anticorps totaux, 12 jours pour les IgM et 14 jours pour les IgG, le niveau maximum (palier) étant atteint après 30 jours pour les trois types d’anticorps. Pendant le première semaine de la maladie, le taux de positivité était de 38,3% pour les anticorps totaux, 28,7% pour les IgM et 19,1% pour les IgG. Après 39 jours de maladie, ces taux de positivité passaient à 100%, 94,3% et 79,8%, respectivement. Dans le même temps, le taux de positivité de l’ARN viral mesuré par RT-PCR sur des prélèvements naseau-pharyngés, était de 66,7% à la fin de la première semaine mais tombait à 45,5 % au jour 39, suggérant que la quantité de virus diminue ou qu’il se focalise sur les parties bases du système respiratoire (bronches) en fonction du temps. La combinaison de la RT-PCR et des dosages sérologiques a permis un gain significatif de sensibilité dans le diagnostic du Covid-19 dès la première semaine, par rapport à la seule mesure de l’ARN viral. Il est à noter que même aux premiers stades de la maladie, certains malades dont l'ARN était indétectable ont pu être confirmés grâce au test de séroconversion. Ces résultats indiquent que le test sérologique est un complément important à la détection de l'ARN au cours de la maladie. Par ailleurs, les résultats ont montré que les taux élevés d’anticorps totaux étaient en corrélation étroite avec la gravité de la maladie. Un taux d’anticorps élevé pourrait donc être considéré comme un facteur de risque de maladie grave, indépendamment de l'âge, du sexe masculin et des comorbidités. Cependant, aucune corrélation n’a pu être établie entre les taux d’anticorps et la clairance virale. De plus, la cinétique de séroconversion était identique quel que soit le statut de gravité de la maladie.
En conclusion, les résultats démontrent que les tests sérologiques ont une valeur diagnostique importante en plus des tests d'ARN par RT-PCR, et fournissent des éléments solides pour le diagnostic et la gestion clinique des patients atteints du COVID-19.
Deuxième étude
Guo et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). Clinical Infectious Diseases 2020
Cette étude a porté sur 140 malades hospitalisés dans deux hôpitaux (Wuhan et Pékin). Au total, 208 échantillons de plasma ont été prélevés sur 82 cas confirmés par RT-PCR et 58 cas probables avec un test RT-PCR négatif mais avec des manifestations cliniques typiques du Covid-19. Le taux des anticorps IgA, IgM et IgG contre le SRAS-CoV-2 a été examiné par un test ELISA utilisant la protéine recombinante de la nucléocapside virale comme capteur. La valeur diagnostique des IgM a été évaluée dans cette cohorte.
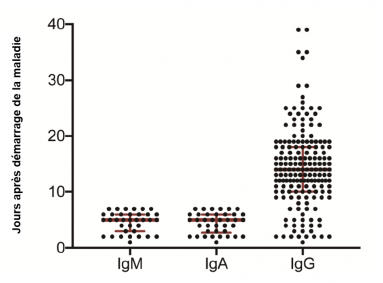
Cinétique d’apparition des anticorps IgM, IgA, et IgG anti-SARS-CoV-2 dans le plasma des malades.
Les plasmas utilisés pour mesurer les IgM et IgA ont été prélevés durant les 7 premiers jours de l’infection. Les plasmas utilisés pour mesurer les IgG ont été collectés sur tous les malades positifs. Chaque point représente un plasma différent issu d’un malade différent (selon Guo et al.)
La durée médiane de détection des anticorps IgM et IgA était de 5 jours avec un taux positif de 85,4%, et 92,7%, respectivement, tandis que les IgG n’ont été détectées que 14 jours après l'apparition des symptômes avec un taux positif de 77,9% (voir la figure ci-dessus). Dans les cas confirmés et probables, les taux positifs d'anticorps IgM étaient de 75,6 % et 93,1 %, respectivement. L'efficacité de la détection des IgM par ELISA IgM est supérieure à celle de la méthode de la RT-PCR après 5,5 jours d'apparition des symptômes. Le taux de détection positive de l’infection est sensiblement plus élevé (98,6 %) lorsque le test ELISA IgM combiné avec la RT-PCR pour chaque patient est comparé au test RT-PCR seul (51,9 %).
Pour évaluer de manière prospective la validité du test ELISA IgM dans le diagnostic de la COVID-19, les chercheurs ont utilisé ce test pour diagnostiquer un cluster familial comprenant trois générations, grands-parents, enfants et petits-enfants. Les grands-parents sont rentrés de Wuhan à Pékin le 22 janvier 2020. La grand-mère a commencé à présenter des symptômes le 2 février, notamment de la fièvre, une toux sèche, et la tomodensitométrie (CT-scan) thoracique a montré des ombres bilatérales irrégulières. Elle s'est révélée positive à la détection de l'ARN viral par RT-PCR. Le grand-père a montré des symptômes légers, nez bouché et écoulement nasal, le 3 février. Les quatre autres membres de la famille ne présentaient aucun symptôme clinique significatif. Le test RT-PCR et la tomodensitométrie thoracique sur la fille, le gendre, le petit-fils et la petite-fille, ont été effectués le 5 février. Le grand-père et la fille n'ont présenté que des résultats anormaux à la tomodensitométrie thoracique, mais se sont révélés négatifs à la détection de l'ARN viral par RT-PCR. Le petit-fils a présenté une positivité à la RT-PCR avec un scan thoracique normal. Le gendre et la petite-fille étaient négatifs à la RT-PCR et avaient des poumons normaux à l'examen tomodensitométrique. Le grand-père, la fille, le gendre et la petite-fille étaient également négatifs pour le CoV-2 du SRAS après la répétition de la détection par RT-PCR, le lendemain. Cependant, les anticorps IgM ont été détectés chez la grand-mère, le grand-père, la fille, le petit-fils et la petite-fille.
En conclusion, ces résultats montrent l'efficacité significative et améliorée de la détection de COVID-19 lorsque les mesures d'IgM sont utilisées pour évaluer des sujets peu ou pas symptomatiques.
Troisième étude
Wu et al. Neutralizing antibody responses to SARS-CoV-2 in a COVID-19 recovered patient cohort and their implications. MedRxiv 2020
(cet article n’a pas encore reçu l’approbation d’un comité de lecture)
Cette étude est légèrement différente des deux précédentes car les chercheurs ont non seulement détecté et quantifié les anticorps circulants mais ont également mesuré leur caractère neutralisant pour l’infection virale dans le but d’évaluer la pertinence d’une sérothérapie du Covid-19.
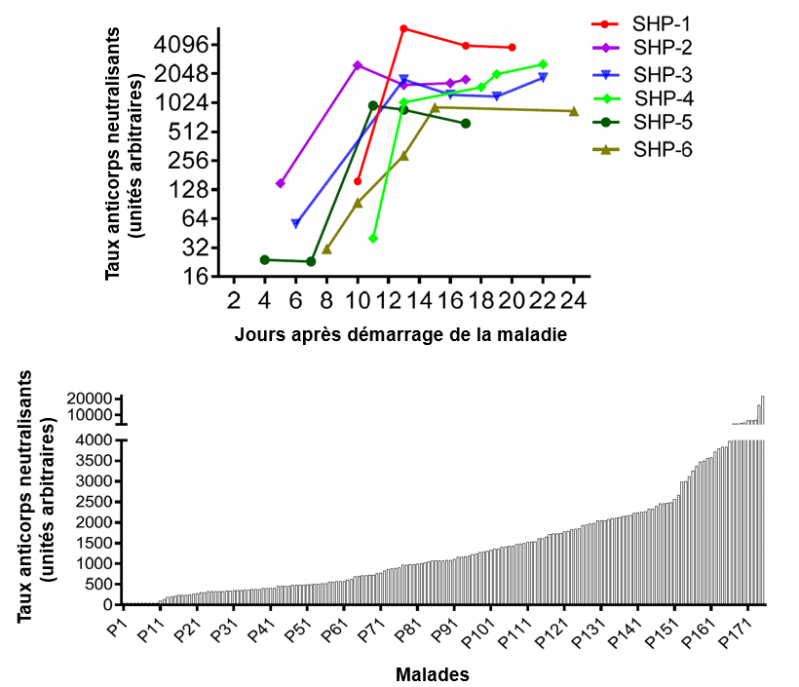
Anticorps neutralisants développés par les malades contre le SARS-CoV-2.
Haut : Cinétique d’apparition des anticorps anti-SARS-CoV-2 chez 6 malades (SHP1 à SHP6).
Bas : Taux des anticorps neutralisants anti-SARS-CoV-2 dans le plasma des 175 malades de la cohorte au jour de leur sortie de l’hôpital. On voit la grande variabbilité entre les malades P1 à P10 et les malades P174 et P175 (selon Wu et al.).
L'étude a porté sur une cohorte de 175 malades adultes atteints du COVID-19 (confirmé en laboratoire) et admis dans le Centre Clinique de Santé Publique de Shanghai. Leurs symptômes étaient légers et aucun d'entre eux n'a été admis en unité de soins intensifs. L'âge médian était de 50 ans (de 16 à 85 ans) et 53 % des étaient des femmes. La durée médiane du séjour à l'hôpital était de 16 jours (allant de 7 à 30 jours), et la durée médiane de la maladie était de 21 jours (9 à 34 jours). L'étude a été menée selon un protocole clinique approuvé par le Comité d'examen des enquêtes dans le cadre de l'enquête clinique de santé publique de Shanghai Centre. Tous les malades avaient donné leur consentement éclairé pour participer à l’étude, et ont été libérés après avoir satisfait aux normes nationales de traitement.
Les anticorps ciblés dans cette étude ont été détectés dans le plasma par un test ELISA utilisant la protéine virale S (fragments S1 et S2) et son domaine de liaison au récepteur (RBD) comme capteurs.
Dans une première partie de l’étude les chercheurs ont vérifié l’effet neutralisant des anticorps plasmatiques sur l’infection in vitro de cellules humaines par le SARS-CoV-2. Les anticorps neutralisants dirigés contre le SRAS-CoV-2 ont été détectés chez les malades du 10eme au 15eme jour après le début de la maladie et sont restés à un niveau stable ensuite. Ces taux étaient variables selon les malades. Les malades âgés (60-85 ans) et d'âge moyen (40-59 ans) présentaient des taux plasmatiques d'anticorps se liant aux divers fragments de la protéine S plus élevés que les jeunes (15-39 ans) : 1537, 1255, and 488, respectivement (en unité arbitraire). Dans la cohorte, 10 malades ne présentaient apparemment pas d’anticorps (taux indétectable par le test ELISA utilisé). En revanche 2 malades présentaient des titres très élevés (15989 and 21567) sans montrer pour autant de signe particuliers de gravité de la maladie. Le taux des anticorps corrélait positivement avec les niveaux de protéine réactive C (un marqueur de la phase inflammatoire aigüe) dans le plasma mais négativement avec le comptage lymphocytaire des malades au moment de l'admission, suggérant que la réponse humorale pourrait jouer un rôle important lorsque la réponse cellulaire est dysfonctionnelle ou altérée.
L’énormes variabilité du taux d’anticorps spécifiques du SRAS-CoV-2 chez les malades du COVID-19 ayant guéri de l’infection posent la question du rôle de ces anticorps dans la progression de la maladie. En clair, chez 10 malades ayant guéri le niveau des anticorps anti-SARS-CoV-2 était indétectable, et chez 30% des malades de la cohorte le taux d’anticorps était très faible (<500). Ceci suggère que d’autres acteurs de la réponse immunitaire (cellules T ou cytokines) aient pu intervenir chez ces malades pour bloquer l’infection.
En conclusion, cette étude fournit des informations intéressantes d’une part pour la mise en place de tests sérologiques, et d’autre part pour la sérothérapie du Covid-19, c’est à dire par utilisation des anticorps sériques développés chez des malades ayant guéri de l’infection afin de traiter des malades en phase de progression de la maladie. Etant donné la variabilité des taux d’anticorps, le sérum des donneurs à utiliser en sérothérapie devra être titrés avant injection. Cependant, une limitation importante de cette étude réside dans le fait que la cohorte examinée ne comportait que des malades légers, aucun d’entre eux n’ayant nécessité une prise en charge dans une unité de soins intensifs.
Conclusion
Le dosage des anticorps anti-SARS-CoV-2 au cours de l’évolution de la maladie est prometteur sur un plan diagnostique et pourrait devenir un élément pronostique dans l’avenir. La cinétique d’apparition des anticorps est similaire dans les trois études et montre une phase de montée située entre les jours 5 et 15 de l’infection avec maintien sur un plateau atteint environ un mois après l’infection. Des études de plus longue durée seront nécessaires et probablement publiées dans les mois qui viennent afin de savoir si l’immunité est maintenue au-delà d’un mois et, si oui, pour quelle durée.
Le dépistage des personnes ayant été infectées par le SARS-CoV-2 et ayant résolu leur infection pourra être réalisé par ces tests sérologiques afin d’argumenter et de sécuriser leur sortie de confinement. Il faudra néanmoins garder en mémoire que ces anticorps peuvent rester indétectables chez certains malades.
Certains résultats semblent discordants entre les études rapportées ici. Notamment, Zhao et al. (première étude) montrent qu’il existe une nette corrélation entre le taux élevé des anticorps et la sévérité de la maladie, alors que Wu et al. (troisième étude) rapportent que des malades âgés avec un taux très élevé d’anticorps n’ont pas développé de symptômes sévères de la maladie. Ce désaccord est probablement lié au faible nombre de malades étudiés et il faudra attendre des études plus larges pour conclure.
L’extrême variabilité des taux d’anticorps spécifiques du SRAS-CoV-2 chez les malades du COVID-19 ayant guéri de l’infection suggère l’implication de facteurs génétiques de l’hôte dans sa relation avec le virus et dans la mise en place de sa réponse immunitaire. Cette possibilité repose sur le fait qu’il existe des polymorphismes génétiques sur certains gènes impliqués dans l’interaction de l’hôte avec les agents pathogènes et dans le contrôle de la réponse immunitaire antivirale, comme par exemple les gènes IRF7, IRF9, TLR3 et ACE2 pour ne citer que ceux-là (Lim et al. J Exp Med 2019 ; Cao et al. Cell Discov 2020). Bien évidemment cela reste à démontrer. Mais des études dans ce sens sont actuellement en cours par divers consortiums internationaux et je resterai attentif à leurs résultats. De plus, un article publié il y a quelques jours par Zhao et al. (MedRxiv 2020) conclut que les personnes du groupe sanguin A présentent un risque nettement plus élevé de contracter le COVID-19 que les personnes des groupes non-A, alors que les personnes du groupe sanguin O ont un risque d'infection moindre que celles des groupes sanguins non-O.
A suivre…
Date de dernière mise à jour : 02/05/2020
Ajouter un commentaire