Thérapie du Vieillissement
Mythe ou réalité ?
Résumé
Pourquoi vieillissons-nous ?
Cette question a hanté les philosophes, penseurs, poètes et artistes depuis la nuit des temps. Plus récemment, elle a excité la curiosité des scientifiques.
Quelles sont les bases biologiques du vieillissement ?
Grâce aux recherches réalisées dans les 25 dernières années, nos connaissances en la matière progressent. Et comme c’est souvent le cas, la connaissance de l’“ennemi” permet de mieux le combattre.
Serait-il possible de mettre en place une thérapie anti-vieillissement ?
Cette question peut paraître insensée, mais…
Aujourd’hui, des travaux sur des animaux de laboratoire montrent que le vieillissement n’est plus une fatalité. Il peut être maîtrisé, ralenti, voire même inversé.
L’heure où ces études s’appliqueront à l’homme approche…
Tel est l'objet de cet article.
Préambule
Ce dont je ne vais pas parler dans cet article: immortalité, cryopréservation, transhumanisme, biothérapie, organes artificiels et cosmétiques.
Quelques bases
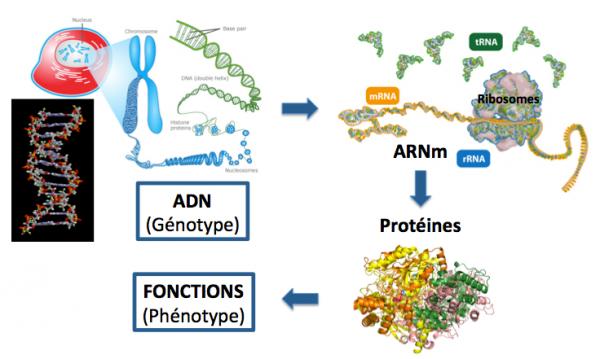
Toutes les cellules qui constituent nos organes sont construites sur le même schéma : une membrane constituée de lipides et protéines, un espace interne le cytoplasme au sein duquel se déroulent toutes les réactions chimiques et biologiques qui permettent à la cellule de vivre, et enfin le noyau dans lequel se trouve notre ADN (constituant des gènes) à l’intérieur des chromosomes, eux-mêmes constitués d'ADN et de protéines (histones). L’ADN est transcrit en ARN messager, réplique exacte (du brin codant) de l’ADN. Cet ARN sort du noyau et est traduit en protéine par les ribosomes dans le cytoplasme. Les protéines assurent les fonctions. Ces diverses opérations constituent ce qu’on appelle “le dogme de la biologie moléculaire” : ADN (génotype) - ARN messager - protéines (phénotype).
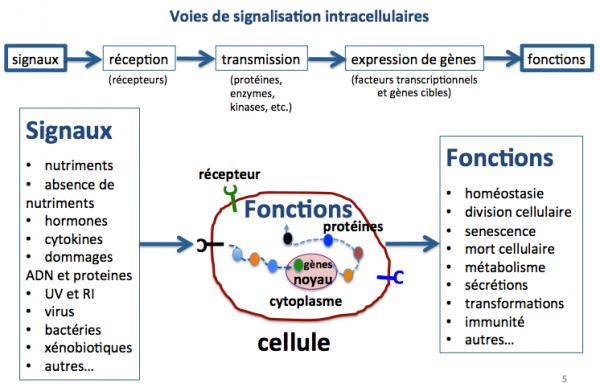
Les cellules ne fonctionnent pas seules au sein des tissus et organes mais reçoivent continuellement des signaux émis par les autres cellules de l’organe, par d’autres tissus et organes ou par l’environnement de l’individu. Ces signaux sont par exemple les nutriments, les hormones, les cytokines, les radiations UV ou autres, les virus, les bactéries, etc. Ils sont détectés par les cellules grâce à des récepteurs (protéines membranaires) qui transmettent l'information à l’intérieur de la cellule au sein de laquelle les réactions chimiques et biologiques se mettent en place afin de permettre la répondre la mieux adaptée. Par exemple, après un repas (nutriments) les cellules du pancréas se mettent à synthétiser l’insuline qui permettra le métabolisme des glucides, des lipides et des protéines, et l'absorption du glucose par les cellules adipeuses, les cellules du foie et des muscles.
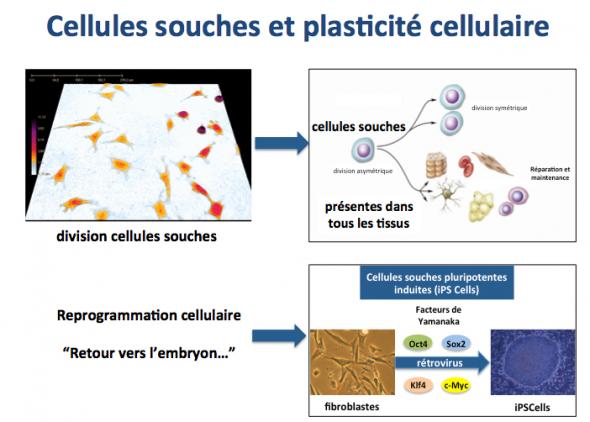
Une catégorie de cellules particulièrement importante est la cellule souche. Les cellules souches sont présentes dans la plupart de nos organes et tissus et en permettent le maintien. A tout instant et dans tous les organes, de nombreuses cellules meurent et sont éliminées. Elles doivent donc être remplacées par de nouvelles, afin de ne pas compromettre la survie de l’individu. C’est le rôle des cellules souches d’assurer cette fonction de maintien.
Ces bases étant posées, quels sont les processus biologiques qui conduisent au vieillissement ?
Le vieillissement: processus biologiques
Trois éléments sont à considérer : les processus stochastiques, les déterminants de la longévité et les maladies liées à l'âge (Hayflick 2007).
1. Processus stochastiques
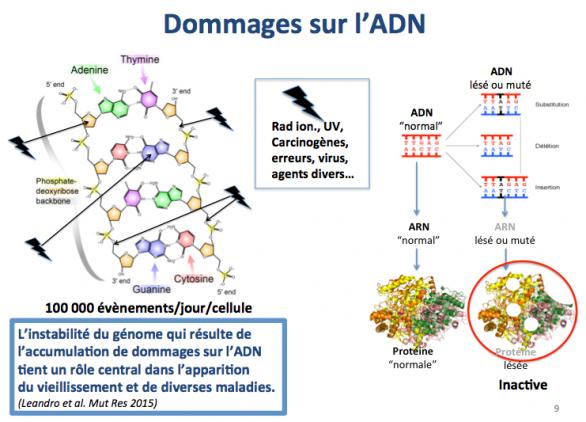
Ce sont des événements dus au hasard ou aux erreurs de fonctionnement de notre “machinerie” cellulaire. A ce propos on a souvent tendance à dire que “l’erreur est humaine”. En fait, il vaudrait mieux dire : “l’erreur est naturelle”. En effet, les enzymes qui synthétisent l'ADN (ADN-polymérases) ou l'ARN (ARN-polymérases) commettent des erreurs, c'est à dire que le nucléotide attendu n'est pas celui qui est synthétisé. En plus de ces erreurs "naturelles", l'ADN est constamment agressé par divers agents comme les rayonnements ionisants, les rayonnements UV, les espèces radicalaires de l'oxygène, les composés carcinogènes, les virus. Ces évènements inopinés entraînent une accumulation de dommages au sein des cellules comme par exemple des cassures dans l’ADN, avec pour conséquences des modifications des protéines, des atteintes aux cellules souches, etc. Dans chaque cellule, on estime que 100 000 (!!!) évènements de ce type se produisent tous les jours (Leandro 2015). Fort heureusement, les systèmes de réparation de l'ADN sont là pour maintenir l'intégrité du génome mais, d'une part, des erreurs sont produites lors de ces réparations et d'autre part, certaines modifications du génome (mutations) peuvent échapper au contrôle exercé par ces systèmes de réparation.
Dommages sur l'ADN et sénescence cellulaire
Une autre cause majeure du vieillissement est le raccourcissement des télomères. Les télomères sont des structures complexes constituées d’ADN et de protéines situées aux extrémités des chromosomes (Blackburn 2006). Les télomères assurent la protection de l'ADN aux extrémités des chromosomes. En effet, une extrémité non protégée de l'ADN en bout de chromosome pourrait être prise par les systèmes de réparation de l'ADN comme une coupure et celle-ci serait alors réparée. Une des conséquences de ce type de réparation pourrait être le "raboutage" avec une autre extrémité non protégée d'ADN par exemple d'un autre chromosome, opération conduisant à une aberration chromosomique (liaison indue entre deux chromosomes différents). D'où le rôle central et critique des télomères qui empêchent la mise en place de ces divers mécanismes de réparation de l'ADN à l'extrémité des chromosomes. Cependant, lors de la division cellulaire (au cours de laquelle les chromosomes doivent être dupliqués pour transmission aux cellules filles) les télomères raccourcissent du fait de l’impossibilité de les régénérer en totalité (une autre imperfection de la machinerie cellulaire).
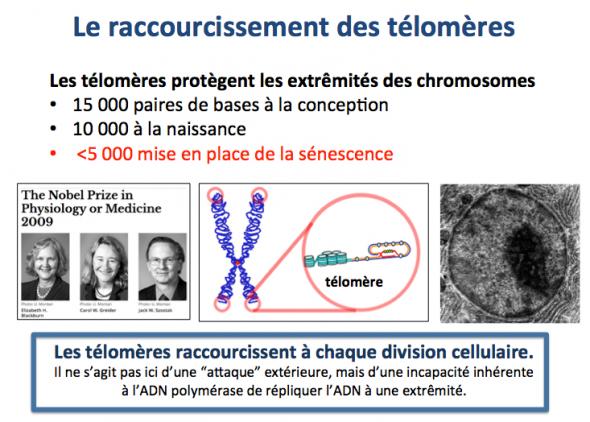
Au fur et à mesure des divisions, les cellules filles reçoivent donc des télomères de plus en plus courts, jusqu’au moment où le seuil limite étant atteint (limite de Hayflick; Hayflick 1965)) la cellule entre en sénescence.
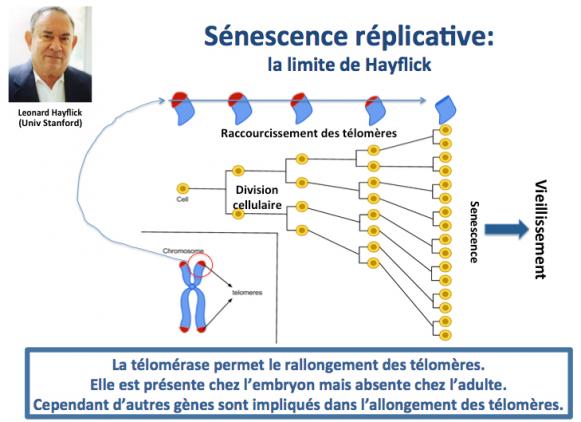
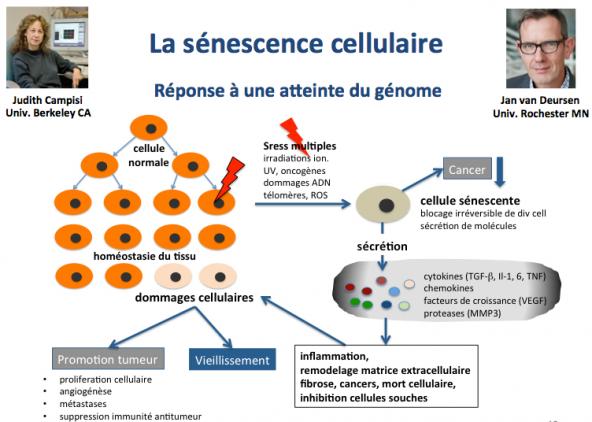
Les cellules en sénescence stoppent définitivement leur capacité à se diviser (Campisi 2005; Baker 2011). Cette entrée des cellules en sénescence est un élément majeur du vieillissement car non seulement les cellules sénescentes ne se multiplient plus, mais de surcroît elles endommagent à leur tour le tissu ou l’organe au sein duquel elles sont situées.
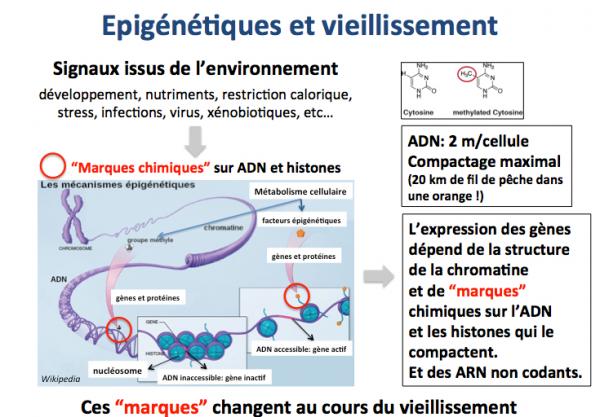
Epigénétique et vieillissement
Le dépôt de marques chimiques (groupes methyl ou acétyl notamment) sur l’ADN et les protéines qui constituent les chromosomes (notamment les histones) en réponse à des signaux de l’environnement module l’activité et l’expression des gènes. Ces processus sont dits épigénétiques. Leur importance est majeure. Par exemple, l’accroissement rapide de la taille moyenne des individus depuis quelques décénies est dû à la qualité de la nutrition et constitue un exemple typique de processus épigénétique. De nombreuses études montrent que ces marques épigénétiques changent continuellement au cours de la vie et peuvent ainsi représenter une autre cause du vieillissement.
Espèces réactives de l'oxygène et vieillissement
Une autre contribution au vieillissement est apportée par l’oxygène. De prime abord cela peut paraître paradoxal puisque sans oxygène la vie est impossible. Cependant, il faut savoir que la molécule d’oxygène (O2) est extrêmement réactive chimiquement et son métabolisme entraîne la formation d’espèces radicalaires (comme par exemple l’ion hydroxyl .OH) qui endommagent l’ADN, les protéines et les lipides (constituants majeurs des membranes cellulaires). Les mitochondries, organelles qui produisent le "carburant" cellulaire, l'ATP, sont une source importante de ces espèces réactives de l'oxygène.
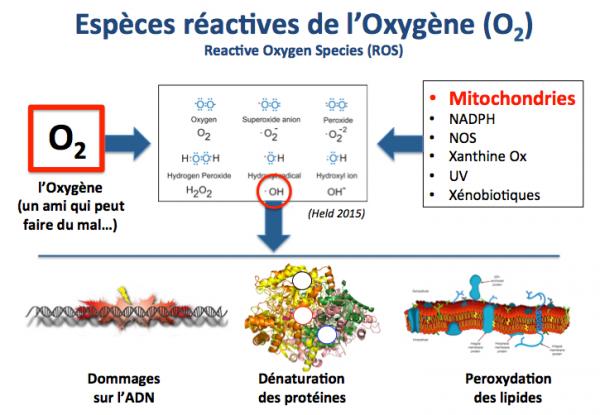
Ces évènements ne sont pas gouvernés par un programme génétique mais uniquement dus au hasard (d’où le terme processus stochastiques).
2. Déterminants de la longévité.
Ce sont les systèmes de réparation et de maintenance. Il existe deux grands systèmes de réparation biologiques.
Les systèmes de réparation de l’ADN
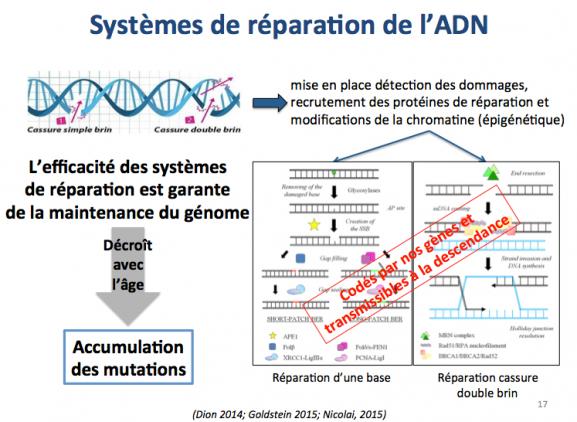
Ces systèmes sont nombreux et garants de l’intégrité et du maintien du génome (Nicolai 2015). Leur contribution à la survie des cellules et, au sens large, à la survie des individus est considérable. Cependant, du fait de l’accumulation des dommages divers (voir précédent paragraphe), ces systèmes de réparation déclinent avec l’âge et cela conduit à l’accroissement des dommages et mutations.
L’autophagie
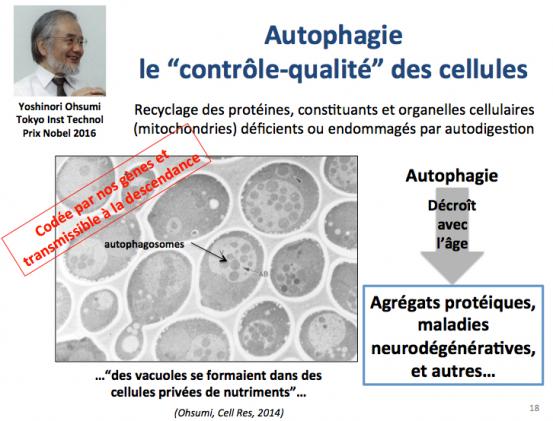
L'autophagie constitue un autre moyen de résister aux dommages dus aux processus stochastiques de dégradation (Ohsumi 2014). Il s’agit d’un processus très complexe de “contrôle-qualité” au cours duquel les cellules recyclent leurs constituants, protéines et organelles cellulaires endommagées. Un exemple typique de mise en place de l’autophagie est la résistance à la carance en nutriments. Cependant, comme dans le cas des systèmes de réparation de l’ADN, l’autophagie décroît avec l’âge et cela conduit à l’accumulation intracellulaire de protéines anormales ou agrégées. Une des conséquences est l’apparition d'agrégats protéiques comme par exemple la maladie d’Alzheimer.
Ces systèmes de réparation de l’ADN et de l’autophagie sont codés par nos gènes et transmissibles à la descendance. Ils préservent la vie de l’individu jusqu’à la maturité sexuelle. Au delà, ils ne sont plus nécessaires à la survie de l’espèce et les dommages excèdent progressivement puis irréversiblement les capacités de réparation et de maintenance. C’est le vieillissement.
3. Maladies liées à l’âge.
Comme leur nom l’indique ce sont les maladies qui apparaissent généralement après la maturité sexuelle et plus communément (mais pas exclusivement) chez le sujet âgé, comme le diabète, les maladies cardiovasculaires, les cancers, les maladies neurodégénératives. Ces maladies apparaissent du fait du vieillissement qui en est la cause première. ET NON L’INVERSE. Ces maladies ne sont PAS la cause du vieillissement.
Les causes de la mort
Il existe deux catégories de cause de mort.
- Les causes extérieures : prédateurs, accidents, infections, famine, froid, etc.
- Les causes intrinsèques : mutations et dommages sur l’ADN et les chromosomes, raccourcissement des télomères, espèces réactives de l’oxygène, etc.
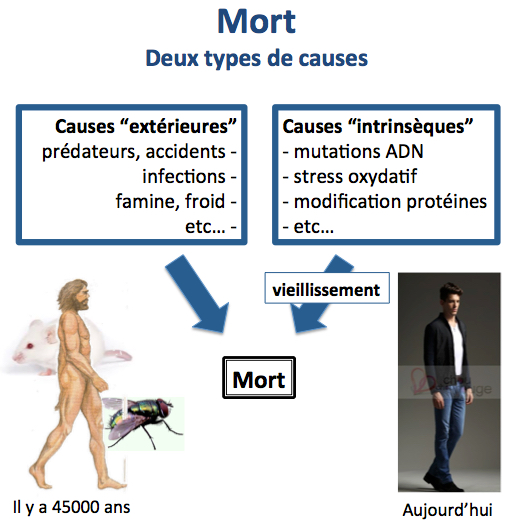
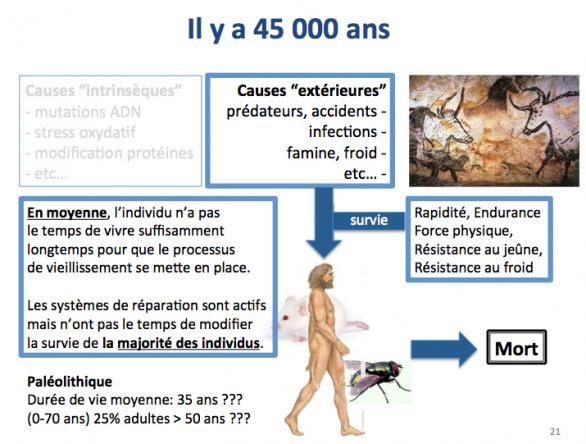
Alors que les causes extérieures de mort prévalaient chez nos lointains ancêtres Homo sapiens il y a 45 000 ans (époque à laquelle ils sont arrivés en Europe), ce sont aujourd’hui les causes intrinsèques qui nous menacent et qui sont responsables de la mise en place des maladies liées à l’âge. La présence d'une souris et d'une mouche sur la figure ci-dessus signifie que ces considérations sont les mêmes pour les animaux. Par exemple une souris sauvage vit rarement au delà de 1 an et meurt le plus souvent de froid ou de famine, alors que les souris de laboratoire vivent largement au delà de deux ans. Bien évidemment, on meurt aujourd'hui aussi d'accidents ou de froid et nos ancêtres Homo sapiens pouvaient (au moins pour certains d'entre eux) vivre jusqu'à 70 ans.
Un point important est de prendre conscience du fait que nous avons hérité de nos ancêtres (Homo sapiens et autres, plus lointains) de stratégies métaboliques grâce auxquelles ils ont survécu dans des conditions difficiles où la nourriture était très aléatoirement disponible et généralement rare (l’examen des restes humains de l’époque le prouve, montrant la présence de fréquentes carences).
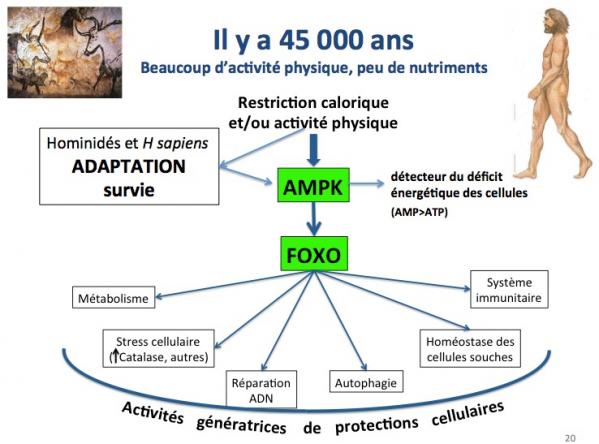
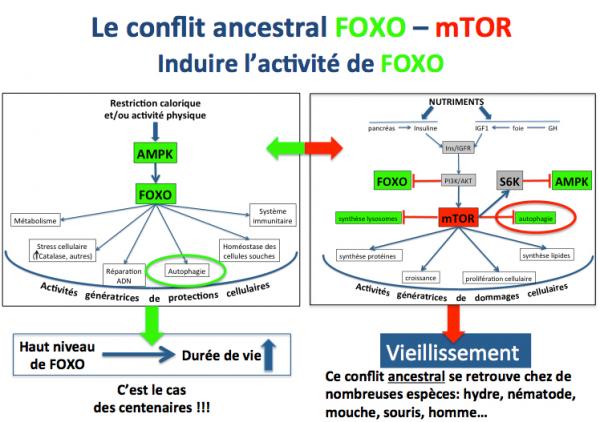
Dans ce contexte où une activité physique intense (recherche de nourriture) cotoyait une restriction calorique importante, les gènes FOXO activés par la protéine AMPK (détecteur du déficit énergétique des cellules) ont joué un rôle majeur en stimulant diverses fonctions génératrices de protection cellulaire : métabolisme adapté, diminution du stress oxydatif, réparation de l’ADN, activation de l'autophagie, maintien des cellules souches, etc.
Il y a 45000 ans, donc, on peut raisonnablement penser que les causes principales de mort étaient les causes “extérieures” et que la survie des individus dépendait surtout de leur rapidité, endurance, force physique, résistance au jeûne (AMPK et FOXO, notamment) et résistance au froid.
Par contre, lorsque la nourriture se présentait (par exemple lors de la capture de gros animaux) il fallait profiter de cette abondance passagère pour faire des réserves cellulaires et croître. Dans ces conditions, c’est le complexe mTOR qui jouait un rôle central dans la mise en place de fonctions telles que la synthèse des protéines et de lipides, la croissance (prolifération cellulaire), et le blocage des fonctions stimulées par FOXO.
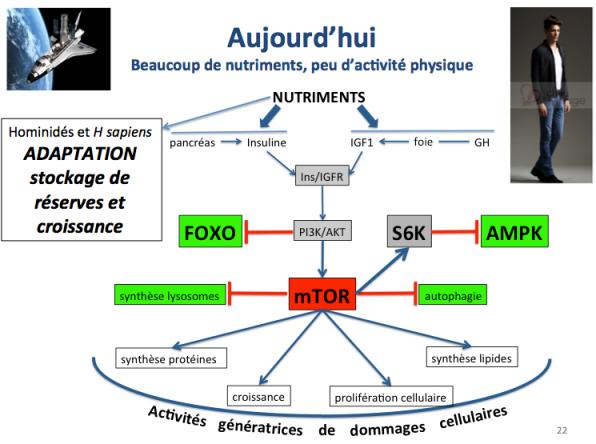
On voit donc que ce conflit permanent et ancestral (présent dans tout le règne animal) entre FOXO et mTOR a constitué le point d’orgue de la survie des premiers Homo sapiens. Aujourd’hui nous n’avons plus à passer notre temps à chercher de la nourriture (il suffit de se munir d'un kadie et de rendre dans un supermarché) mais ce conflit existe toujours au niveau de nos cellules. Et le problème est que toutes les fonctions activées par mTOR sont génératrices de dommages cellulaires. L’épidémie d’obésité qui sévit aujourd’hui en est une des conséquences directes la plus évidente.
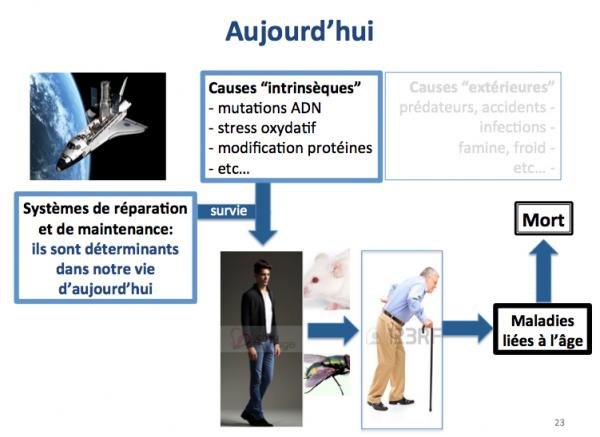
Aujourd'hui donc, même si les causes extérieures de mort subsistent (accidents, infections, etc.), les causes de mort les plus fréquentes sont les causes intrinsèques, mutations sur l'ADN, stress oxydant, inhibition de l'autophagie, etc, et la survie des individus dépend surtout des systèmes de réparation et de maintenance, c'est à dire les déterminants de la longévité.
Ces considérations sur le vieillissement et les causes de mort étant posées, peut-on envisager une thérapie du vieillissement et si oui, laquelle ?
Thérapies du vieillissement
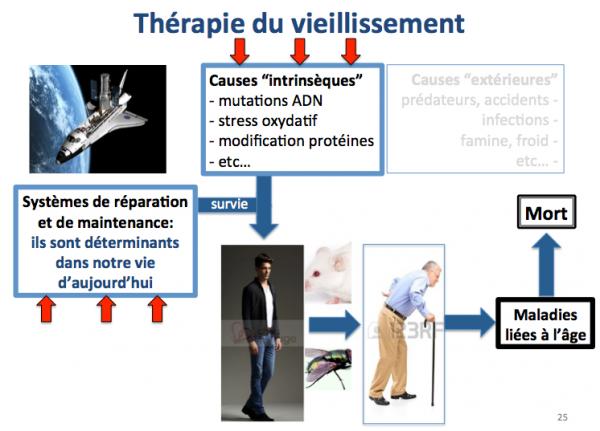
D'après ce que nous venons d'évoquer dans les paragraphes précédents, toute thérapie anti-vieillissement doit passer par un meilleur contrôle des causes "intrinsèques" de mort et donc par l'amélioration et/ou la sauvegarde de nos systèmes de réparation et de maintenance.
Vous trouverez dans ce qui suit quelques exemples de thérapie du vieillissement déjà évalués chez des modèles animaux.
1. Diminuer la production de progérine
La progérine est un marqueur du vieillissement vasculaire et de la peau chez l'individu "normal" (McClintock 2007). Cette protéine est cependant plus connue pour son rôle dans une maladie génétique rare et dévastatrice, la Progéria (Scaffidi 2006).
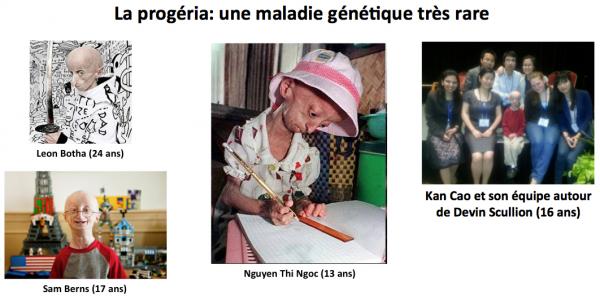
Comme le montre les images ci-dessus, la progéria est une maladie du vieillissement accéléré. Les enfants qui en sont atteints manifestent un vieillissement 8 fois plus rapide que la normale. Leur durée de vie moyenne est 13 ans. Ils décèdent généralement de maladies cardiovasculaires. La progéria est due à une mutation de novo (non transmise par les parents) dans le gène LMNA qui code pour une protéine appelée lamine A. La lamine A fonctionnelle joue un rôle majeur dans l'architecture de la membrane nucléaire ainsi que dans de nombreuses fonctions nucléaires. Cette mutation (en position 1824 C>T dans l'ARNm) ne modifie pas la séquence de la protéine (en position 608, Gly-Gly), mais induit un épissage illégitime de l'ARN messager de sorte que la protéine produite est amputée d'une cinquantaine d'acides aminés avec comme conséquence un remplacement de la lamine A par la progérine (une lamine tronquée).
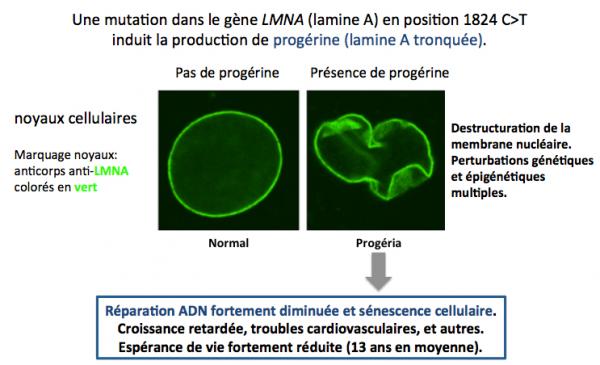
Comme le montre l'image ci-dessus, la progérine n'est pas capable d'assurer les fonctions de la lamine A, et non seulement l'architecture de la membrane nucléaire est fortement affectée, mais également un grand nombre de fonctions nucléaires sont perturbées: réparation de l'ADN, maintien des télomères, transcription des gènes, perturbation épigénétiques, etc (Cao 2011). D'où la maladie. Une possibilité de thérapie de la progéria est donc de diminuer la production de progérine.
C'est la démarche suivie par des chercheurs Français et Espagnols (Osorio 2011).

Ces chercheurs ont "construit" une souris transgénique portant la même mutation du gène LMNA que celle trouvée chez les enfants atteints de progéria. Comme le montre la figure ci-dessus, cette souris présente non seulement une petite taille, mais également une durée de vie très raccourcie à environ 120 jours (au lieu de 2 ans). Les chercheurs ont mis au point une stratégie génétique afin d'empêcher la production de progérine par utlisation d'un oligonucléotide (petit fragment d'ADN) appelé MxEx10/11 qui bloque le site d'épissage illégitime de l'ARNm de LMNA conduisant à la production de progérine. On constate chez les souris traitées avec cet oligonucléotide MxEx10/11 une taille normale et un allongement très significatif (+40%) de leur diurée de vie.
Curieusement l'épissage anormal dû à la mutation dans le gène LMNA se produit de façon spontanée chez les individus non porteur de la mutation (1824 C>T) au cours du vieillissement. Cette stratégie pourrait donc faire partie dans le futur de l'arsenal anti-vieillissement.
2. Induire l'activité de la télomérase
La télomérase est la protéine (enzyme) qui assure le maintien de la longueur des télomères. Cependant cette protéine n'est exprimée que durant l'embryogénèse et dans les cellules cancéreuses. Chez l'adulte sain, elle n'est pas présente: le gène hTERT qui code pour cette protéine n'est pas activé.
Le groupe de Maria Blasco (Centre National du Cancer à Madrid; Blasco 2012) a construit une souris transgénique (Tg-TERT) dans laquelle le gène TERT s'exprime durant la vie adulte de l'animal. Du fait que la télomérase ne s'exprime que dans les cellules cancéreuses (et peut donc induire des cancers), les souris Tg-TERT ont été croisées avec des souris cancer-résistantes (SP53/SP16/SArf, exprimant des gènes supprésseurs de tumeurs). Les animaux obtenus suite à ce croisement (Tg-TERT/SP53/SP16/SArf) ont été étudiés en détail.
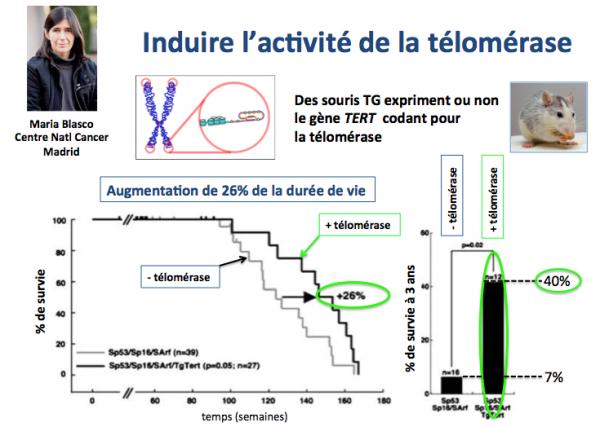
Comme le montre la figure ci-dessus, les animaux exprimant la télomérase ont une durée de vie moyenne augmentée de 26% par rapport à ceux qui ne l'expriment pas. De plus, 40% des animaux exprimant TERT survivent au delà de l'âge de 3 ans, alors que seulement 7% atteingnent cet âge chez ceux n'exprimant pas la télomérase.
Une première expérience de ce type a été réalisée chez une jeune femme, Elizabeth Parrish qui dirige BIOVIVA, une compagnie Américaine de recherche sur le vieillissement.

Le 15 septembre 2015, Elizabeth Parrish s’est volontairement soumise à une thérapie génique au cours de laquelle une injection intraveineuse d’un adénovirus exprimant la télomérase humaine lui a été administrée. Un an après, les télomères de ses lymphocytes T étaient passés de 6.7kb à 7.3kb, ce qui correspond à un “rajeunissement” de 20 ans (tests réalisés par deux laboratoires indépendants, Allemand et Américain). D’autres tests suivront dans les années à venir...
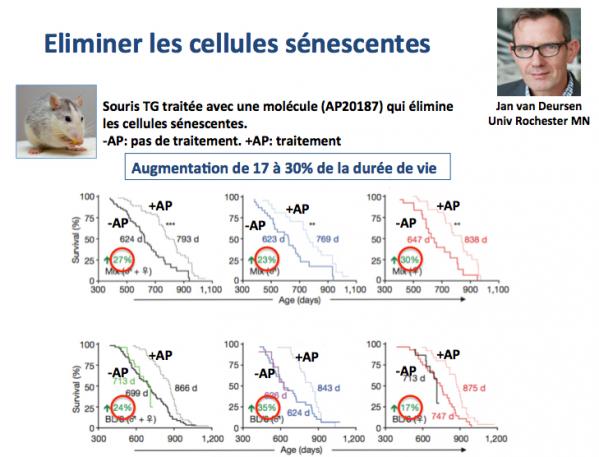
3. Eliminer les cellules sénescentes
Nous avons vu que le raccourcissement des télomères conduit, au delà d'une limite inférieure de longueur, à la sénescence cellulaire. Les cellules sénescentes sont irréversiblement bloquées dans un état de non prolifération, un phénotype qui au cours de l'évolution a dû être sélectionné pour éviter la survenue de cancers. En effet, la perte des télomères entraînerait la production de coupures double brin de l'ADN aux extrêmités des chromosomes, un procéssus qui conduirait à des "aboutements" illicites entre chromosomes (aberrations chromosomiques). Le problème est que les cellules sénescentes endommagent à leur tour le tissu ou l’organe au sein duquel elles sont situées du fait d'un relargage de protéines telles que des cytokines, chémokines, facteurs de croissance et protéases. Ces protéines sont responsables d'inflammation, de remodelage de la matrice extracellulaire, de fibrose, de mort cellulaire et d'inhibition de la croissance des cellules souches, autant de processus dont on sait qu'ils conduisent au vieillissement et à la promotion des cancers.
Une stratégie anti-vieillissement consisterait donc à réduire l'impact des cellules sénescentes en les éliminant. C'est précisément ce qui été réalisé par le groupe de Jan van Deursen (Baker 2016). Ces chercheurs ont utilisé des souris transgéniques porteuses d'un "montage" génétique (Baker 2011) permettant d'éliminer les cellules sénescentes (exprimant le marqueur p16) en réponse à une molécule synthètique AP20187. Comme le montrent les résultats de la figure ci-dessous, cette stratégie conduit à une augmentation de la durée de demi-vie des souris traitées avec le AP20187 de 17 à 30%.
4. Rétablir les marques épigénétiques
Nous avons vu que le raccourcissement des télomères conduit, au delà d'une limite inférieure de longueur, à la sénescence cellulaire. Les cellules sénescentes sont irréversiblement bloquées dans un état de non prolifération et génèrent dans leur environnement immédiat des protéines telles que des cytokines, chémokines, facteurs de croissance et protéases. Ces protéines sont responsables d'inflammation, de remodelage de la matrice extracellulaire, de fibrose, de mort cellulaire et d'inhibition de la croissance des cellules souches, autant de processus dont on sait qu'ils conduisent au vieillissement et à la promotion des cancers.
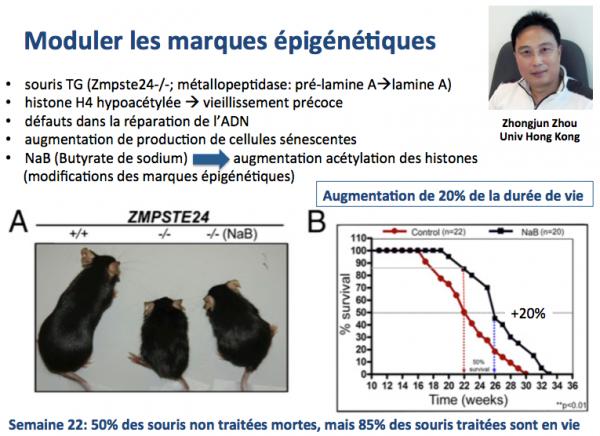
La figure ci-dessus décrit une série d'expériences réalisées par le groupe de Zhongjun Zhou (Krishnan 2011). Ces chercheurs ont utilisé un modèle de souris transgénique dans lesquelles le gène Zmpste24 est invalidé (absent). La protéine Zmpste24 a pour fonction l'activation de la lamine A à partir de la pré-lamine A. Sans cette protéine, pas de lamine A. Or, nous avons vu plus haut (paragraphe 1. Diminuer la production de progérine) que le dysfonctionnement de la lamine A conduit à la progéria, avec pour conséquence un vieillissement accéléré. Les souris dépourvues de Zmpste24 vieillissent prématurément et manifestent une instabilité génomique et un surcroît de cellules sénescentes du fait d'un déficit de recrutement des protéines qui interviennent dans la réparation de l'ADN endommagé.
En étudiant le mécanisme de ce vieillissement, les chercheurs ont identifé chez ces souris un déficit épigénétique, c'est à dire un déficit en acétylation des histones. Les histone sont des protéines associées à l'ADN au sein des chromosomes et un de leur rôle est de contrôler le compactage de l'ADN dans les nucléosomes, une action qui conduit à l'expression ou la non-expression de gènes, selon leur degré d'acétylation, une marque épigénétique. Notamment, ils ont observé que l'histone H4 était hypoacétylée au niveau de la lysine 16, une conséquence d'un défaut d'association de la protéine Mof (une histone acetyltransferase, c'est à dire une protéine qui acétyle les histones) à la matrice nucléaire. Puisque les marques épigénétiques sont réversibles, diverses stratégies ont été testées pour confirmer cette hypothèse. Notamment, une surexpression de la protéine Mof (acétylation des histones) ou une inhibition de la dé-acétylation des histones ont permis un recrutement accru des protéines de réparation de l'ADN aux site endommagés et une diminution substantielle des marqueurs du vieillissement dans ce modèle. L'expérience décrite ci-dessus montre que le butyrate de sodium dont on sait qu'il augmente l'acétylation des histones entraînait une augmentation de 20% de la durée de demi-vie des animaux. Ces résultats montrent qu'un rétablissement des marques épigénétiques (dans ce cas acétylation des histones) pourrait constituer une thérapie intéressante dans les syndromes progéroïdes et le vieillissement. En effet, les souris sauvages (exemptes de toute mutation) montrent aussi une diminution de l'acétylation de l'histone H4 sur la lysine 16. au cours du vieillissement normal.
5. Arbitrer le conflit FOXO-mTOR
Comme je l’ai dit plus haut, l’activité de FOXO contribue à stimuler des fonctions de protection cellulaire alors que l’activité de mTOR, au contraire, contribue à stimuler des fonctions de croissance qui s'avèrent génératrices de dommages cellulaires.
Dans le cadre d’une thérapie du vieillissement, on a donc intérêt à augmenter l’activité de FOXO et à diminuer l’activité de mTOR. C’est précidsément ce qui a été testé.
Des études nombreuses chez l’animal ont montré qu’une activation de FOXO augmentait de façon importante la durée de demi-vie (100% chez le nématode et de 20 à 30% chez les rongeurs).
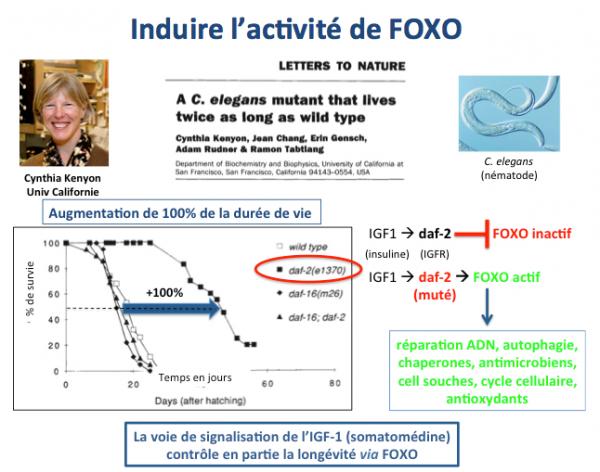
La figure ci-dessus résume les observations rapportées par le groupe de Cynthia Kenyon en 2010 (Bartke 2008; Kenyon 2010). En étudiant divers mutants du nématode C. elegans, ces chercheurs ont trouvé un mutant (daf-2) dont la durée de vie moyenne montrait un doublement. L'analyse génétique de ce mutant montra que son gène daf-2 qui est un équivalent du récepteur de l'IGF1 (Insulin-like growth factor, la somatomédine) était muté et inactif. Or, ce récepteur contrôle négativement FOXO (en inhibant son activité) via l'action de la kinase PI3K/AKT. D'où une expression continuelle de FOXO chez ce mutant avec pour conséquence une forte augmentation de sa durée de demi-vie.
Un stimulant particulier de l’activité de FOXO est la restriction calorique, c’est à dire une réduction de 25% de l’apport calorique journalier. Par exemple, on passe de 2400 à 1800 calories chez l’homme et de 2000 à 1500 calories chez la femme.
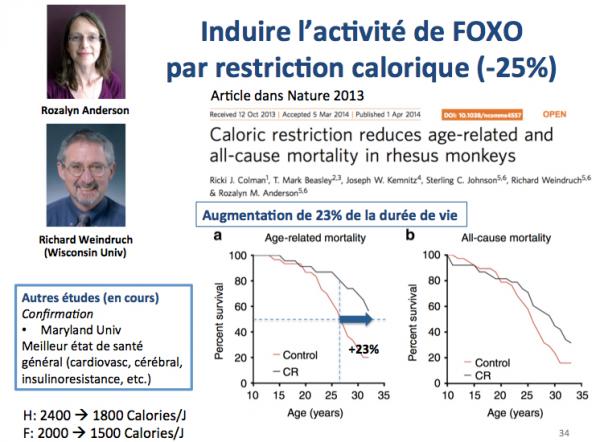
Comme le montre la figure ci-dessus, cette stratégie a prouvé son efficacité sur divers modèles animaux. On voit ici une augmentation significative (+23% ) de la durée de demi-vie chez le singe rhésus (Colman 2013).
Une autre alternative est de diminuer l'activité de mTOR. La rapamycine, une molécule (antibiotique macrolide) découverte en 1970 sur l’Ile de Pâques par un groupe Canadien, s’est avérée récemment être un puissant inhibiteur de l’activité de mTOR.
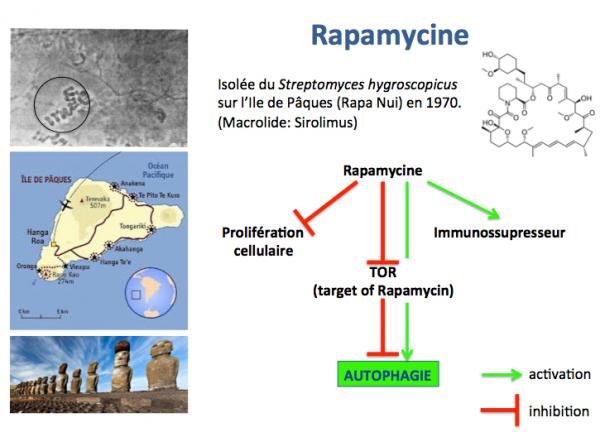
Des études conduites sur plusieurs espèces animales ont confirmé que le traitement des animaux par la rapamycine sur une longue période entraînait une augmentation significative de leur durée de demi-vie.
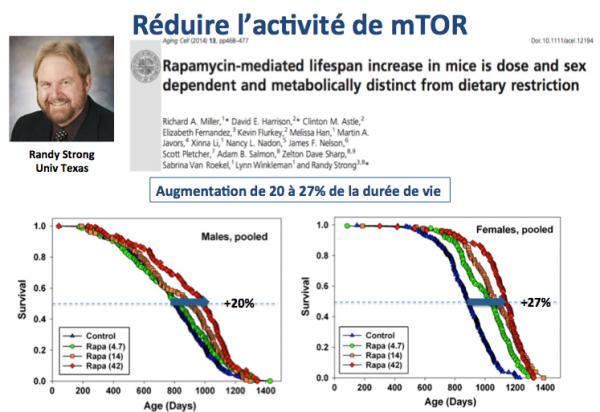
La figure ci-dessus résume les résultats obtenus par le groupe de Randy Strong (Miller 2014). Des rats (males et femelles) ont été traités avec des doses croissantes de Rapamycine. L'augmentation moyenne de durée de demi-vie était de 20 et 27% respectivement pour les males et les femelles.
6. Rôle de l’axe hypothalamo-hypophysaire dans le vieillissement
L’hypothalamus est une petite structure située sur la face ventrale de l’encéphale.
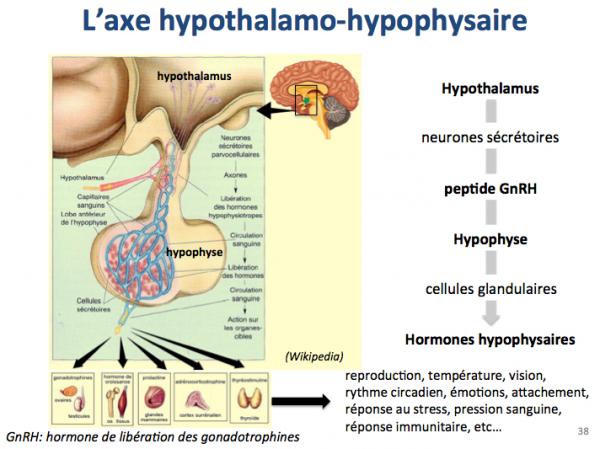
Une des fonctions de l'hypothalamus est de réaliser la liaison entre le système nerveux central et le système endocrinien par le biais d'une glande endocrine : l'hypophyse. L’hypothalamus projette les connections de ses neurones sécrétoires vers l’hypophyse. Ces neurones produisent un peptide, l’hormone de libération des gonadotrophines (appelée peptide GnRH) qui va stimuler les cellules glandulaires de l’hypophyse, entraînant ainsi la production des hormones hypophysaires contrôlant un grand nombre de fonctions vitales comme la reproduction, la température, la vision, le rythme circadien, les émotions, l’attachement, la réponse au stress, la pression sanguine, la réponse immunitaire, etc.
Des études récentes, notamment celles menées dans le groupe de Dongsheng Cai (A. Einstein Coll. NY) montrent que l’hypothalamus joue un rôle déterminant dans le contrôle du vieillissement (Zhang 2013).
Voici, brièvement exposé, ce qui se passe.
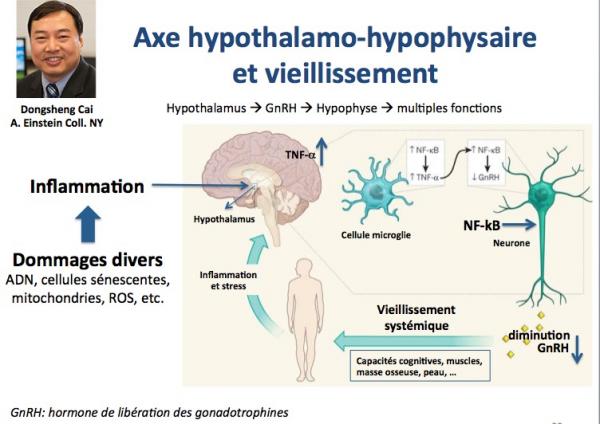
Il a été récemment montré que les cellules de l’hypothalamus, comme toutes les cellules de l’organisme, sont soumises aux dommages divers touchant l’ADN, les cellules souches, les protéines (voir plus haut). Il en résulte une inflammation qui entraîne l’expression d’un gène codant pour un facteur appelé NF-kB par les cellules de la microglie (macrophages résidents cérébraux). NF-kB entraîne à son tour une forte inhibition de la production du peptide GnRH par les neurones sécrétoires de l’hypothalamus, via l'action intermédiaire du TNF-alpha. D’où une contribution au vieillissement systémique. Les chercheurs ont donc tenté deux approches:
- diminuer l'expression de NF-kB
- augmenter le taux de GnRH.
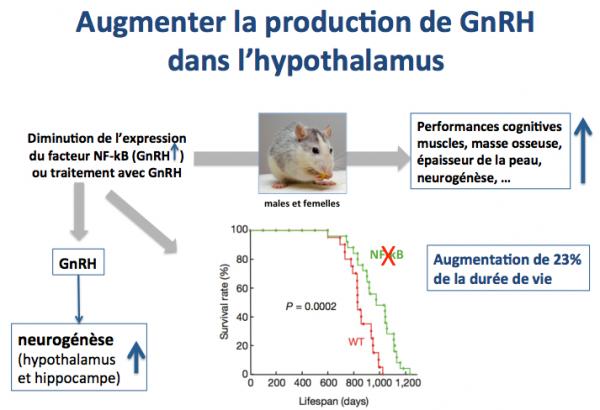
Ce scenario a été testé de deux façons chez la souris, d’une part en diminuant l’expression de NF-kB par approche génétique et d’autre part en traitant les animaux vieillissants avec le peptide GnRH par approche pharmacologique. Dans les deux cas une forte amélioration des paramètres biologiques marqueurs du vieillissement a été constatée avec une durée de demi-vie augmentée de 23%, comme le montrent les résultats présentés sur la figure ci-dessus.
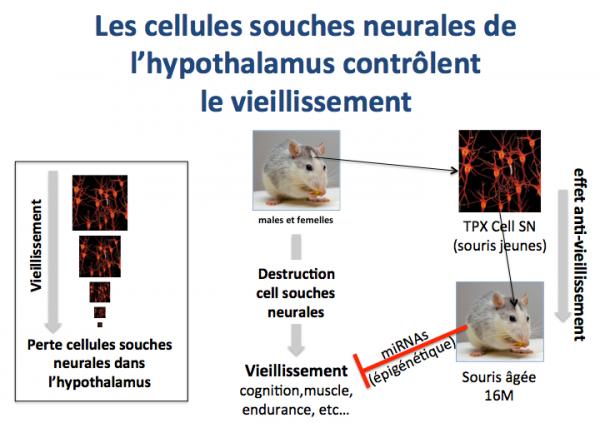
De plus, ces chercheurs (Zhang 2017) ont montré que l’accumulation des cellules souches neurales de l’hypothalamus diminuait au cours du vieillissement et la transplantation chez des animaux âgés de cellules souches neurales prélevées chez des animaux jeunes entraînait une nette amélioration des paramètres biologiques marqueurs du vieillissement.
7. Reprogrammation cellulaire
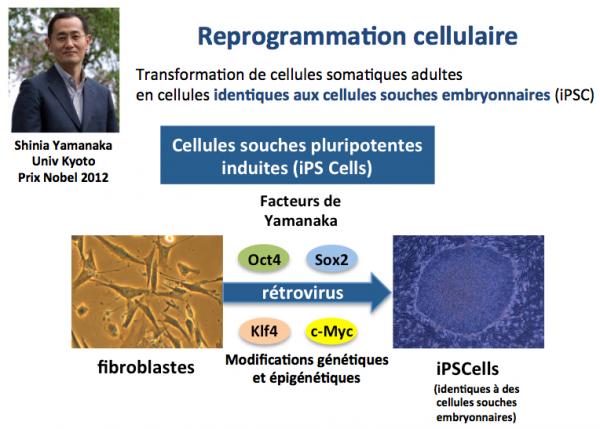
Nous savons depuis la fin des années 2000 avec les travaux de Shinia Yamanaka (qui lui ont valu le prix Nobel en 2012) que des cellules somatiques adultes peuvent "revenir" vers un phénotype embryonnaire si on les transfecte avec une série de facteurs transcriptionnels tels que Oct4, Sox2, Klf4 et c-Myc (les facteurs de Yamanaka), comme le résume la figure ci-dessous (Takahashi 2006).
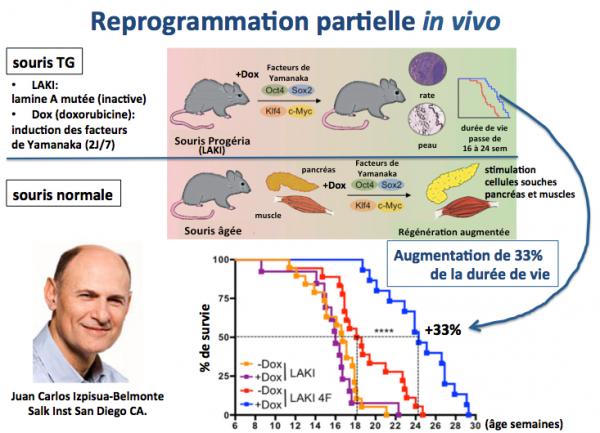
Une étape nouvelle a été éfranchie avec les travaux du groupe de Juan Carlos Izpisua-Belmonte (Ocampo 2016). Ces chercheurs ont montré que la reprogrammation cellulaire peut être réalisée in vivo sur des souris atteintes de progéria (vieillissement accéléré, souris "LAKI" sur la figure ci-dessous). Ils ont pour ce faire transfecté les animaux avec les quatre facteurs de Yamanaka selon un protocole cyclique et pour de courtes durées (2 jour par semaine, par administration de doxorubicine), afin d’éviter une exposition chronique et prolongée des animaux à ces facteurs. Les résultats montrent qu’après reprogrammation la survie moyenne des souris progéria, dont la durée de vie moyenne est de 16 semaines, passe à 24 semaines, soit une augmentation de durée de vie de 50% ! Dans le même temps, ils montrent que ce même protocole appliqué à des souris normales mais âgées améliore de façon sensible divers paramètres physiologiques marqueurs du vieillissement sur divers organes comme le muscle et le pancréas. Ces travaux montrent l’impact des dérégulations épigénétiques sur le processus de vieillissement et ouvrent la voie à de futures applications dans le domaine de la thérapie du vieillissement (voir sur ce site: Des souris reprogrammées).
8. Durée de vie comparée de quelques espèces
La nature n’a pas fini de nous surprendre et une étude sur le vieillissement ne viendra pas infirmer ce cliché (Owen 2014). Toutes les espèces vivant sur la planète ne présentent pas les mêmes particularités quant à leur vieillissement.

Pour preuve, les données démographiques publiées par Jones 2014, sur quarante-six espèces vivantes, incluant l’homme et des animaux (mammifères, vertébrés et invertébrés) et végétaux (arbres, plantes et algues). Ces données révèlent l’extraordinaire diversité biologique en matière de vieillissement et vont à l’encontre de toutes les théories connues. On savait que la durée de vie moyenne des espèces varie de quelques jours chez la mouche, à quelques décades chez l’homme et à plusieurs siècles chez l’hydre. De même, l’évolution du taux de mortalité (nombre de morts pour mille individus par an) et de fertilité (nombre de descendants par individu à un âge donné) est extrêmement variable, en fonction de l’âge, d’une espèce à une autre.
Que nous disent les théories actuelles? Que les lois de l’évolution conduisent à une augmentation de la mortalité et un déclin de la fertilité après l’âge de la maturité, comme c’est le cas chez l’homme. Personne ne contesterait cette assertion. Ainsi, une étude menée en 2009 sur des Japonaises centenaires a montré que leur taux de mortalité augmente de plus en plus rapidement avec l’âge, du fait d’une dégradation accélérée de l’organisme. Rien d’étonnant en apparence. Cependant, et contre toute attente, cette caractéristique fait de l’espèce humaine un cas à part ! Aucune autre espèce parmi les quarante-six étudiées ici ne montre un tel emballement de leur taux de mortalité en fonction de l’âge, pas même le chimpanzé, notre plus proche parent. Certes, d’autres espèces comme l’étourneau de Bali, le guppy, le fulmar argenté, l’orque, la puce d’eau, le lion voient aussi leur taux de mortalité augmenter avec l’âge, mais beaucoup plus lentement. Cependant, chez l’hydre d’eau douce, l’abalone (Haliotis rufescens, ormeau ou oreille de mer), le Bernard l'Hermite, l’épervier, le lézard, le taux de mortalité reste constant en fonction de l’âge. Leur corps ne semble pas se dégrader au cours du temps, ce qui suggère une absence de vieillissement. D’autres, comme le corail, l’algue brune ou la tortue du désert, voient même leur taux de mortalité diminuer avec l’âge ! Cela ne signifie pas pour autant que ces espèces sont immortelles puisqu’elles restent soumises aux "causes extérieures" (comme nous l'avons vu plus haut) qui prévalent dans un environnement potentiellement hostile (famine, déficits nutritionnels, accidents, prédateurs, infections, etc.), mais simplement que leur probabilité de mourir de maladies liées à l’âge n’augmente pas ou, au contraire, diminue avec l’âge.
Il y a une autre croyance que ces nouveaux résultats démentent : l’idée que les espèces à courte durée de vie meurent du fait d’un vieillissement accéléré; autrement dit, leur taux de mortalité augmenterait fortement au cours du temps. Ce n’est pas le cas. Par exemple, le taux de mortalité du campagnol (Microtus oeconomus) augmente à peine avec l’âge, alors que la durée de vie de cet animal n’excède pas un an. Ces singularités s’appliquent également à la fertilité. Alors que la femme ne peut procréer au-delà de sa première partie de vie, la fertilité de la femelle du singe jaune, de la puce d’eau, du chevreuil, du pou, du crocodile reste constante et, plus remarquablement encore, celle du martinet royal et de nombreux invertébrés et espèces végétales augmente avec l’âge !
Pourquoi l’évolution des espèces a-t-elle conduit à des différences aussi importantes ? Cela reste un mystère pour les biologistes. Pour une espèce donnée, les taux de mortalité et de fertilité en fonction de l’âge dépendent de l’environnement dans lequel elle vit et s’est adaptée. Et c’est vraisemblablement dans la compréhension de ce dialogue entre génétique/épigénétique et environnement que se trouvera la réponse aux questions posées.
9. Le cas du rat taupe
Le cas du rat taupe est tout à fait remarquable. Ce rongeur de la taille d'une souris vit plus de 30 ans dans son habitat naturel. Pourquoi une telle longévité ? C'est la question que posait récemment l'équipe de Vera Gorbunova de l'Université de Rochester (Zhao 2018).
Pour tenter d'apporter des éléments de réponse à cette question, ces chercheurs ont soumis le rat taupe à des radiations ionisantes dont on sait qu'elles affectent lourdement le génome (dommages sur l'ADN). La figure ci-dessous résume les résultats obtenus. Par rapport à des rongeurs de taille voisine (rat et souris) le rat taupe montre une meilleure réparation de l'ADN, une activité télomérase plus élevée, une meilleure induction de l'autophagie et une induction des gènes de réponse au stress oxydant, autant de processus qui entrent dans la liste des déterminants de la longévité et dont on sait qu'il jouent un rôle majeur dans la "résistance" au vieillissement.

10. Les super-seniors
Selon les prévisions de l'Organisation Mondiale de la Santé (OMS), le nombre de personnes ayant atteint l'âge de 85 ans et plus devrait augmenter de 350% entre 2010 et 2050. Notamment, le sous-groupe des centenaires devrait voir son nombre augmenter d'un facteur 10, ce qui fait du groupe des super-seniors (85 ans et plus) celui qui manifeste la plus forte augmentation par rapport aux autres groupes d'âge, dans les pays développés.
Nous venons de voir dans les paragraphes précédents que le vieillissement est un processus de dégénérescence multifactoriel causé par l'accumulation de dommages moléculaires et cellulaires conduisant au dysfonctionnement des cellules et des tissus de l'organisme. Les mécanismes contribuant au vieillissement et aux maladies liées à l'âge sont notamment les dommages à l'ADN, le raccourcissement des télomères, la sénescence cellulaire, les modifications épigénétiques, le stress oxydatif. Nous avons vu également que les déterminants de la longévité tels que les systèmes de réparation de l'ADN et l'autophagie, permettaient de contrôler ces processus dégénératifs, et divers groupes de recherche ont montré l'effet "bénéfique" de la stimulation de ces systèmes sur la durée de vie de divers modèles animaux.
Dans ce contexte, certains auteurs ont pris le problème à l'envers: ils ont cherché à savoir si les systèmes de réparation et autres déterminants de la longévité étaient plus actifs (plus performants) chez des super-seniors (âgés de 90 ans ou plus, centenaires ou super-centenaires, dont Jeanne Calment est la représentante la plus célèbre) par rapport la populations générale. La figure ci-dessous résumé leurs résultats (voir Franzke 2015 pour une large revue des données publiées sur ce sujet par de nombreux autres groupes de recherche).

Ces résultats montrent de façon incontestable que certains des déterminants de la longévité sont maintenus à un niveau de performance élevé (comparable à celui de personnes jeunes) chez ces super-seniors qui semblent "résistants" aux maladies liées à l'âge.
Il est cependant très important de signaler ici que si les déterminants de la longévité sont transmis génétiquement et sont donc héréditaires, l'hygiène de vie (excercice régulier, nutrition adaptée, absence de stress psychologique et social, etc.) reste un facteur extrêmement important pour le contrôle du vieillissement, à côté des prédispositions génétiques.
On peut, à partir de là, envisager une thérapie du vieillissement qui serait basée sur la maintenance ou l'activation de ces déterminants.
11. La thérapie anti-vieillissement
Les diverses stratégies de la thérapie anti-vieillissement sont représentés ci-dessous. Rappelons qu'il ne s'agit pas ici de rechercher l'immortalité mais de retarder (ou empêcher) l'apparation des maladies liées à l'âge.
En d'autre terme, il s'agit de vieillir en bonne santé.

On notera au moins trois stratégies:
- Pharmacologique : utilisation de petites molécules synthétiques ou naturelles (exemple la rapamycine)
- Génétique : thérapie génique par ADN, oligonucléotides ou petits ARN
- Biothérapeutique : utilisation de cellules souches permettant la régénération de tissus lésés.
Pour le moment nous ne savons pas si ces thérapies pourraient avoir un effet curatif chez des personnes dont le vieillissement est déjà engagé (âge > 60 ans) ou préventif sur des personnes jeunes, ou les deux.
Résumé
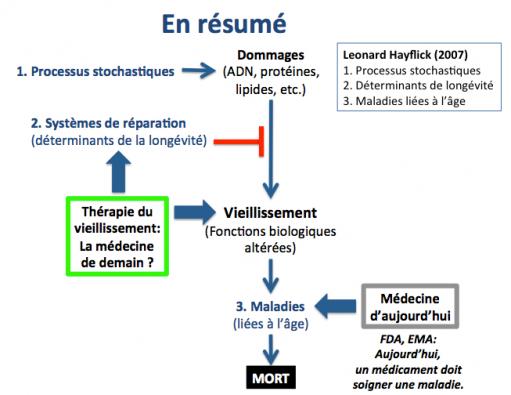
En résumé :
1. le vieillissement est le résultats de processus stochastiques tels que l'accumulation de dommages à l'ADN conduisant au dysfonctionnement des cellules et des tissus de l'organisme.
2. les déterminants de la longévité tels que les systèmes de réparation de l'ADN et l'autophagie, permettent de contrôler ces processus dégénératifs, et selon leur activité chez l'individu considéré, ces déterminants ralentissement ou empêchent l'apparation des maladies liées à l'âge.
3. ce sont dans la plupart des cas les maladies liées à l'âge (cancers, diabète, maladies cardiovasculaires, maladies neurodégénératives) qui sont responsables de la mort.
La médecine d'aujourd'hui ne s'intèresse qu'à ces maladies liées à l'âge. Par exemple, pour les agences de la régulation pharmaceutique telles que la FDA aux Etats Unis ou la EMA en Europe, un médicament doit soigner une maladie.
On voit qu'en intervenant en amont sur les déterminants de la longévité, la thérapie du vieillissement pourrait constituer une nouvelle branche de la médecine de demain.
Bibliographie
Date de dernière mise à jour : 25/08/2018
Commentaires
-

- 1. JUNG Martial Le 28/11/2020
Très instructif pour un néophyte comme moi et impressionnant travail. Je ne sais si je m'adresse à vous, Monsieur Maurel, mais quand je vois toutes les études que vous avez effectuées, toutes les conférences que vous avez données tout en étant le papa de cinq enfants, je me dis que le vieillissement vous concerne peu puisque vous êtes capable de faire en une vie ce qui, chez la plupart d'entre nous, en nécessiterait quatre ou cinq.
Avec toute mon admiration.
Martial Jung
Ajouter un commentaire
