Malaria: nouveau traitement
Résumé tout public
Le paludisme encore appelé malaria tue plus de 600 000 personnes chaque année dans le monde (Rapport OMS 2022). En 2021, on estime que 247 millions de personnes ont été touchées et 619 000 en sont mortes, 77% d'entre elles étant des enfants de moins de 5 ans. Cette affection est due à la présence dans le sang d'un parasite unicellulaire (protozoaire) le Plasmodium falciparum transmis par la piqûre d'un moustique femelle du genre Anophèle. Selon l'Institut Pasteur, le paludisme serait apparu en Afrique il y a au moins 20 000 ans.
Les symptômes de la maladie sont généralement peu spécifiques et consistent en fièvre, maux de tête, malaise, faiblesse, troubles gastro-intestinaux (nausées, vomissements, diarrhée), douleurs dorsales, myalgies, frissons et/ou toux, troubles neurologiques (vertiges, confusion, désorientation, coma). Le diagnostic de paludisme doit également être envisagé chez toute personne présentant une fièvre d'origine inconnue, indépendamment de ses antécédents de voyage.
La transmission de la maladie d'un homme infecté à un homme sain est assurée par la piqûre d'un moustique femelle du genre Anophèles. Le cycle de développement des Plasmodium falciparum implique deux hôtes: un vertébré (homme ou animal) chez qui se déroule un cycle asexué foie-globules rouges, et un invertébré (l'anophèle femelle) chez qui se déroule le cycle sexué.
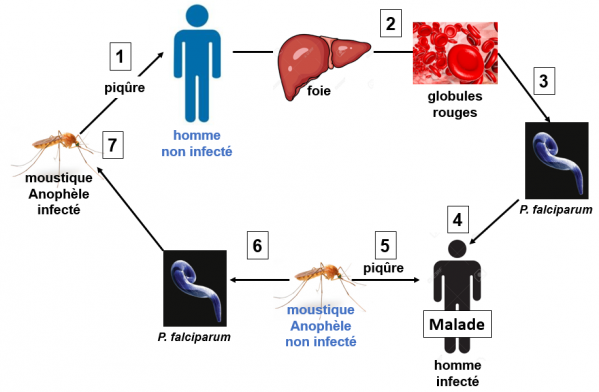
Cycle du P. falciparum chez ses deux hotes, le moustique et l'homme
1. Un homme non infecté est piqué par un moustique anophèle femelle infectée par le parasite P. falciparum. 2. Le cycle asexué (foie, globules rouges) du parasite se met en place chez l'homme. Ce cycle produit également les précurseurs (gamétocytes males et femelles) du développement sexué du parasite. 3. Une quantité importante de parasites est produite dans le sang. 4. La maladie se déclare. 5. L'homme infecté est piqué par un moustique non infecté. 6. Lors de son repas de sang, le moustique absorbe les formes sexuées (gamétocytes males et femelles) du parasite et le cycle sexué se met en place; une quantité importante de parasites est produite. Ces parasites rejoignent la glande salivaire du moustique. 7. Le moustique est maintenant prêt à infecter une autre personne.
Diverses stratégies de lutte contre la maladie existent :
- Utilisation de mousticaires et de produits répulsifs
- Traitements pharmacologiques (chloroquine, pyrimethamine, sulfadoxine, artemisinine et diverses combinaisons de ces traitements). Malheureusement ces traitements ne sont que partiellement efficaces du fait de la résistance qui se développe chez les moustiques.
- Un vaccin (le RTS,S) contre le parasite P. falciparum existe et est recommandé par l'OMS, mais il n'offre qu'une protection incomplète.
- Un nouveau vaccin (le R21/Matrix-M) vient d'être mis sur le marché et offre une protection supérieure à celle du RTS,S, de l'ordre de 75% (article paru le 1er février 2024 dans le Lancet, par Datoo et al.)
- Modifications génétiques de l'insecte conduisant à une élimination de l'insecte sauvage ou un remplacement de celui-ci par une espèce OGM non sensible à l'infection par le parasite. Ces approches posent des problèmes i) au niveau de la biodiversité et ii) au niveau de leur acceptation par les populations humaines concernées.
Dans un article paru le 4 août 2023 dans la revue internationale Science, des chercheurs affirment avoir trouvé une nouvelle arme contre le parasite:
Une bactérie naturelle (Delftia tsuruhatensis) infecte les moustiques anophèles et stoppe le développement sexué du Plasmodium dans leur intestin en libérant une molécule inhibitrice, l'harmane.
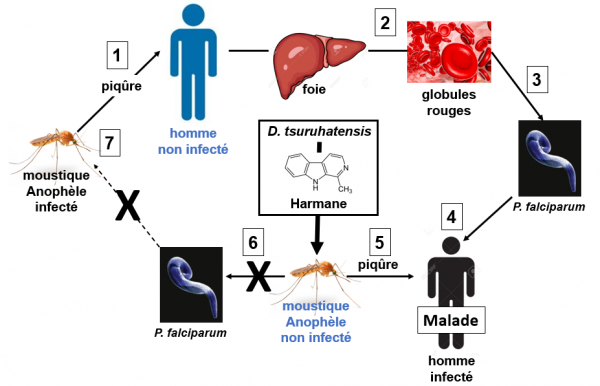
Effet de l'harmane produit par la bactérie D. tsuruhatensis sur le cycle du P. falciparum chez le moustique
Lorsque les moustiques anophèles sont infectés par la bactérie D. tsuruhatensis (soit après ingestion, soit par simple contact) ils ne sont plus capables de développer le cycle sexué du parasite. Ce cycle est bloqué (X) dans l'intestin de l'insecte par l'harmane produit par la bactérie. L'insecte perd de ce fait son pouvoir infectieux sur l'homme.
Cette découverte ajoute une nouvelle arme aux méthodes de prévention du paludisme existantes. Des études sont actuellement en cours pour poursuivre le développement d'un outil de lutte contre le paludisme basé sur la bactérie D. tsuruhatensis, qui pourrait être utilisée en conjonction avec les stratégies existantes pour parvenir à l'éradication mondiale du paludisme.
Victimes célèbres du paludisme : Toutankhamon, Alexandre le grand, Gensis Khan et Georges Washington
______________________________________________________
Pour aller plus loin…
Manifestations cliniques du paludisme
Les manifestations cliniques du paludisme apparaissent au début de la phase sanguine, lorsque la parasitémie dépasse un seuil, variable selon les individus. Cette multiplication asexuée des plasmodiums à l'intérieur des hématies fait du paludisme une maladie parasitaire des globules rouges.
La lyse des hématies parasitées (éclatement des schizontes mûrs ou rosaces) libère de nouveaux parasites (mérozoïtes) qui contaminent à leur tour d'autres hématies. Cette destruction entraine aussi une libération des déchets du métabolisme plasmodial (pigments et débris cellulaires du globule rouge, ou hémozoïne), ces substances pyrogènes perturbent le fonctionnement de l'hypothalamus (production de cytokine comme le TNFα) et causent de fortes fièvres.
Les premiers cycles sont d'abord asynchrones (paludisme de primo-invasion, avec fièvre continue ou anarchique), puis ils se synchronisent selon un rythme périodique, en fonction de l'espèce de Plasmodium. Le temps qui s'écoule entre la pénétration d'un parasite dans un globule rouge et l'éclatement de celui-ci est assez constant et atteint chez l'être humain 48 heures pour P. vivax, P. ovale et P. falciparum (fièvres tierces), 72 heures pour P. malariae (fièvre quarte) ; et pour P. knowlesi, la dernière espèce confirmée chez l'Homme, 24 heures seulement.
En cas de parasitisme intense, la destruction des globules rouges est telle qu'il apparait une anémie hémolytique et un ictère. L'organisme réagit par une hyperplasie (production accrue) des macrophages, ce qui explique l'augmentation de taille du foie (hépatomégalie) et de la rate (splénomégalie).
P. falciparum se distingue des autres espèces de Plasmodium en ayant la capacité d'effectuer sa phase sanguine au niveau des capillaires viscéraux, notamment du tissu cérébral. Il peut se former alors des « rosettes » (amas d'hématies saines et parasitées), formations qui adhèrent aux parois des capillaires. Cette situation peut s'accompagner d'une hypoxie secondaire, de perturbations métaboliques et hydro-électrolytique, de lésion vasculaires (parois des petites vaisseaux) et tissulaires.
Non traité, le paludisme par P. falciparum présente un risque vital immédiat (risque de syndrome de défaillance multiviscérale, par exemple). Les différents paludismes sont susceptibles d'évoluer vers des formes chroniques (formes historiques), avec détérioration progressive de l'état général pouvant aboutir à la cachexie (affaiblissement général lié à une forte dénutrition).
Causes
Le paludisme est causé par une infection par des parasites du genre Plasmodium. Chez l'homme, six espèces de Plasmodium peuvent être impliquées : P. falciparum, P. malariae, P. ovale curtisi, P. ovale wallikeri, P. vivax et P. knowlesi. L'espèce la plus fréquemment identifiée (~75%) chez les malades est P. falciparum, suivie de P. vivax (~20%). Bien que P. falciparum soit traditionnellement responsable de la majorité des décès, des données récentes suggèrent que le paludisme dû à P. vivax est associé à des conditions potentiellement mortelles aussi souvent qu'à un diagnostic d'infection à P. falciparum.
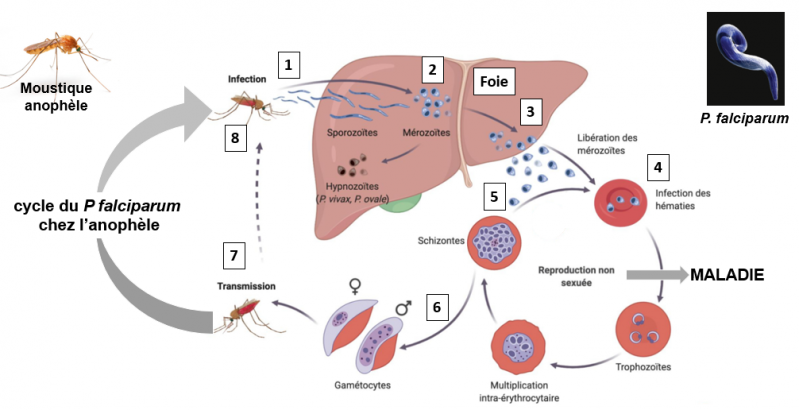
Cycle du P falciparum chez l'homme
1. Les parasites (appelés "sporozoïtes") sont introduits par la piqûre d'une femelle d'anophèle infectée, gestante. C'est justement du fait que la femelle est gestante qu'elle va avoir besoin de repas de sang.
2. Certains de ces sporozoïtes inoculés, restent dans la peau, mais la plupart voyage dans la circulation sanguine jusqu'au foie, où ils envahissent les hépatocytes via les cellules de Kupffer. Ils se développent sous la forme de mérozoïtes (forme invasive des cellules du parasite) et se divisent dans le foie pendant 2 à 10 jours. Chaque hépatocyte infecté finit par héberger jusqu'à 40 000 mérozoïtes.
3 et 4. Les hépatocytes infectés sont détruits et libèrent les mérozoïtes dans la circulation sanguine où ils envahissent rapidement les globules rouges (hématies), se répliquant en 24 à 72 heures pour former 16 à 32 nouveaux mérozoïtes par cellule.
5. Dans le globule rouge infecté, le parasite passe par plusieurs stades de développement, mérozoïte, trophozoïte, schizonte (dernier stade qui peut contenir plusieurs dizaines de mérozoïtes) ce qui conduit à la lyse du globule rouge et à la libération de nouveaux mérozoïtes qui infectent immédiatement de nouveaux globules rouges. Cette étape qui constitue la reproduction "non sexuée" (schozogonie), amplifie continuellement le nombre de parasites chez une personne infectée.
6. Au cours de ce cycle d'infection, une petite partie des mérozoïtes ne se réplique pas, mais se transforme en parasites au stade sexuel précoce, appelés "gamétocytes" mâles et femelles. Ces gamétocytes se développent dans la moelle osseuse pendant 11 jours, puis retournent dans la circulation sanguine en attendant d'être absorbés par la piqûre d'un autre moustique.
7 et 8. Une fois à l'intérieur d'un moustique, les gamétocytes subissent une reproduction sexuelle et finissent par former des sporozoïtes filles qui migrent vers les glandes salivaires du moustique pour être injectées à un nouvel hôte lors de la piqûre du moustique (Cowman et al. Cell 2016).Voir la video: https://www.wehi.edu.au/wehi-tv/malaria-lifecycle-part-1-human-host/
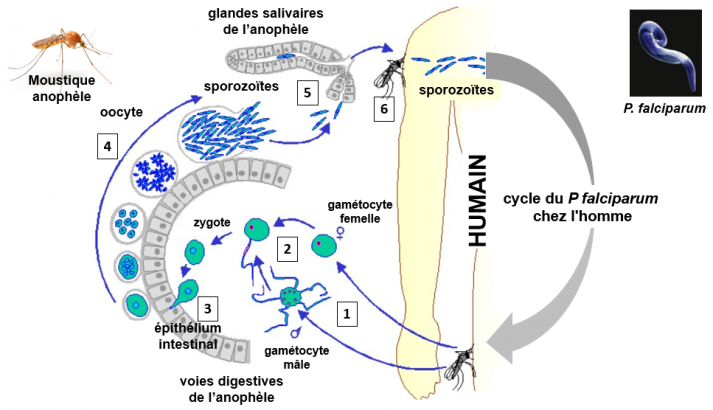
Cycle du P falciparum chez le moustique
1. Lors d’un repas de sang sur un homme infecté, un moustique anophèle femelle ingère les différents stades du parasite, c'est à dire les formes asexués (sporozoïte, mérozoïte, trophozoïte, schizonte) et les gamétocytes mâles et femelles.
2. Dans l'estomac du moustique, les formes asexuées sont digérées, le gamétocyte femelle donne un unique gamète femelle, et le gamétocyte mâle se divise en quatre gamètes mâles mobiles, de forme filamentaire. Ceux-ci vont passer dans l’intestin moyen de l’insecte et se transformer en gamètes. Suite à la fécondation, le zygote obtenu devient un oocinète.
3. L'oocinète franchit la barrière (épithélium) de l'intestin moyen de l'insecte. Au niveau de la lame basale de cet épithélium, un oocyte à paroi épaisse se forme.
4. C'est à l'intérieur de ce dernier que se déroule une série de mitoses qui donne naissance aux sporozoïtes.
5. Les sporozoïtes mobiles migrent vers les glandes salivaires.
6. La femelle est alors infectante. Les sporozoïtes seront transmis à l'homme lors d'un nouveau repas de sang du moustique, et cycle du P falciparum va reprendre chez l'homme. Voir la vidéo: https://www.wehi.edu.au/wehi-tv/malaria-lifecycle-part-2-mosquito-host/
Huang et al. Delftia tsuruhatensis TC1 symbiont suppresses malaria transmission by anopheline mosquitoes. Science 2023
Dans cet article publié dans la revue Science le 4 août dernier, les auteurs décrivent les propriétés d'une bactérie symbiotique naturelle, non génétiquement modifiée, Delftia tsuruhatensis TC1. Cette bactérie a été isolée à partir de moustiques qui dans des conditions de recherche expérimentale étaient incapables de soutenir le développement des parasites Plasmodium falciparum, responsables de la malaria.
La bactérie D. tsuruhatensis TC1 inhibe sans aucune modification génétique les premiers stades du développement du P. falciparum et la transmission ultérieure par le moustique Anophèles grâce à la sécrétion d'une petite molécule inhibitrice, l'harmane. Les chercheurs ont montré qu'au contact du moustique, l'harmane pénètre la cuticule et inhibe le développement du P. falciparum dans l'intestin du moustique, où le parasite se développe avant de se déplacer vers les glandes salivaires de l'insecte.
Pour l'heure on ne sait comment cette bactérie est arrivée dans l'intestin de certaines souches de moustiques Anophèle, bien qu'elle ait déjà été observée dans l'intestin de certains insectes, ainsi que dans l'eau, le sol et, rarement, dans des infections contractées en milieu hospitalier. Mais ce qui est certain est que lorsque les chercheurs ont mis en contact cette bactérie avec les moustiques, elle a empêché le parasite P. falciparum de les infecter.
La bactérie D. tsuruhatensis TC1 peuple de manière stable l'intestin du moustique, ne lui impose pas de coût d'adaptation et inhibe le développement du P. falciparum pendant toute la durée de vie du moustique. Des études de terrain en milieu confiné au Burkina Faso et des études de modélisation ont montré que la bactérie D. tsuruhatensis T C1 a le potentiel de compléter l'arsenal des méthodes de contrôle de la transmission du paludisme ciblé sur les moustiques.
Par rapport aux moustiques dépourvus de la bactérie, les insectes porteurs de D. tsuruhatensis TC1 présentent environ 75 % d'oocystes de Plasmodium en moins (structures semblables à des œufs que le parasite forme dans l'intestin de l'insecte, voir la figure ci-dessus).
Des expériences menées sur des rongeurs ont révélé que cette perturbation de la croissance du P. falciparum entraînait une réduction de la transmission : seulement un tiers des souris piquées par des moustiques porteurs de la bactérie D. tsuruhatensis TC1 ont été infectées, contre 100 % des souris piquées par des moustiques ordinaires.
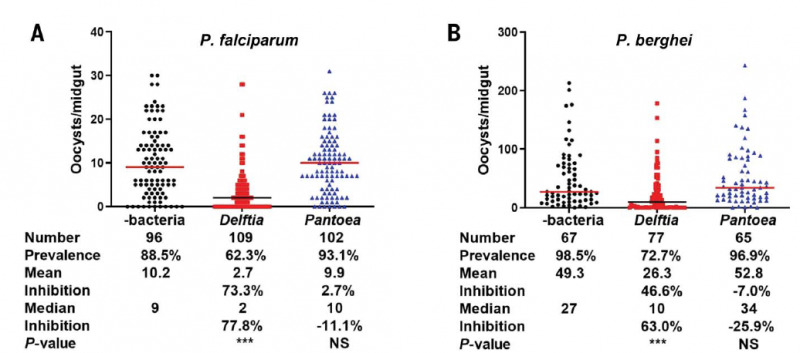
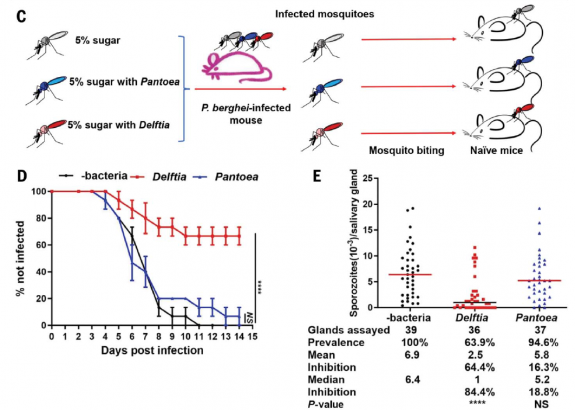
Effet de l'infection des anophèles par la bactérie D. tsuruhatensis sur l'infection parasitaire produite après piqûre chez des souris
Formation d'oocystes de P. falciparum (A) et de P. berghei (B, parasite spécifique des rongeurs) chez les moustiques porteurs de la bactérie D. tsuruhatensis TC1. La production d'oocytes chez les moustiques porteurs de la bactérie D. tsuruhatensis TC1 est fortement inhibée (77,8%) par rapport à celle observée chez les moustiques témoins ou porteurs de Pantoea agglomerans (une bactérie sans effet sur le Plasmodium). (C) Procèdure expérimentale: des anophèles de deux jours ont été nourris avec ou sans 107 bactéries/ml de Delftia tsuruhatensis ou Pantoea pendant la nuit. Deux jours plus tard, les moustiques ont été nourris sur la même souris infectée par P. berghei, en veillant à ce que tous les moustiques ingèrent du sang infecté avec la même parasitémie. Après 21 à 23 jours, lorsque les sporozoïtes ont atteint les glandes salivaires, les moustiques ont été choisis au hasard et mis en contact avec des souris naïves (trois moustiques par souris). (D) La parasitémie de chaque souris a été suivie quotidiennement pendant 14 jours. Les barres représentent l'erreur standard de la moyenne. On constte une forte diminution de la parasitémie chez les souries piquées par des moustiques infectés par D tsuruhatensis (courbe rouge). (E) Le nombre de sporozoïtes par glande salivaire est inhibé de 84,4%. Données regroupées de trois expériences indépendantes, chacune utilisant cinq souris par groupe testé pour un total de 15 souris. L'analyse statistique a été déterminée par le test log-rank (Mantel-Cox) (D) ou par le test U de Mann-Whitney (E). Pour (D), contrôle et Delftia : P < 0,0001 ; contrôle et Pantoea : P = 0.6702. Pour (E), contrôle et Delftia : P < 0,0001 ; contrôle et Pantoea : P = 0.2825. NS, non significatif. (Vue partielle de la figure 1 de l'article de Huang et al. 2023)
Le fractionnement du surnageant de culture de D. tsuruhatensis TC1 a permis de découvrir et d'identifier un petit composé hydrophobe, l'harmane, présent à des niveaux de l'ordre du nanogramme dans les fractions actives. L'harmane, un dérivé de la carboline, a été isolé pour la première fois à partir d'Arariba rubra (ou Simira rubra). Il est présent dans les extraits de plantes utilisés en médecine traditionnelle au Mali et à Sao Tomé, dans les tissus et les fluides corporels des mammifères, ainsi que dans divers aliments, notamment la viande et le poisson frits, les boissons alcoolisées et les cafés.
Les dérivés de la b-carboline sont connus pour leurs propriétés insecticides, fongicides et régulatrices de la croissance des plantes et ont été étudiés pour leur activité contre plusieurs parasites. La présente étude révèle que l'harmane n'inhibe pas les stades asexués du paludisme, mais qu'il cible spécifiquement la formation des oocytes chez le moustique à des concentrations nanomolaires, réduisant de manière significative la prévalence des sporozoïtes dans les glandes salivaires. L'harmane a une demi-vie courte chez les moustiques (1 à 2 jours). Des modifications de sa structure chimique ou le développement de formulations à libération lente pourraient permettre de prolonger son efficacité au-delà de 2 jours. Il est important de noter que l'harmane peut être administré aux moustiques par contact et que sa capacité à traverser leur cuticule offre des modalités supplémentaires pour l'administration via les surfaces de repos des moustiques.
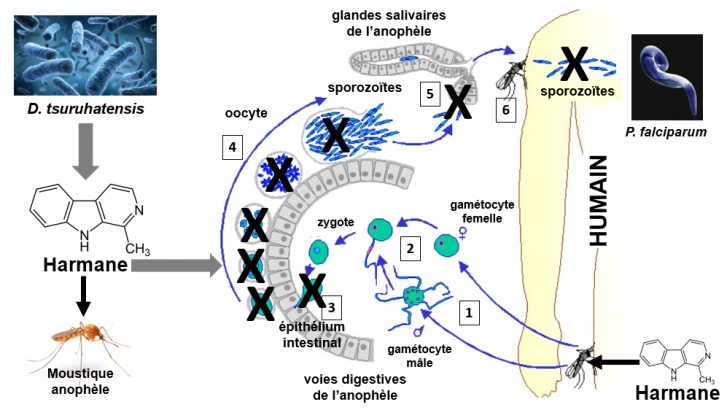
Effet de l'harmane sur le cycle du Plasmodium chez le moustique anophèle
Les croix noires représentent les sites de l'inhibition produite par l'harmane sur les stades de développement du Plasmodium.
Cette étude fait de D. tsuruhatensis TC1 un outil très intéressant pour la prévention du paludisme. Il suffit aux moustiques de consommer un peu de la bactérie pour être colonisés, et une fois à l'intérieur de l'insecte, la bactérie y reste, bloquant continuellement le développement du parasite. De plus, D. tsuruhatensis TC1 ne semble pas affecter la survie du moustique ni celle de sa progéniture, ce qui signifie qu'il est peu probable que les insectes développent une résistance à cette bactérie.
Dans une dernière série d'expériences, les scientifiques ont testé l'approche sur des moustiques dans un enclos en filet de 10 sur 10 mètres de côté et sur 5 mètres de hauteur, conçu pour simuler le monde réel avec des plantes et des zones de reproduction. Il a suffi de laisser placer des boules de coton imbibées de sucre et de D. tsuruhatensis TC1 dans cet enclos pour que les trois quarts de la population de moustiques soient colonisés par la bactérie au cours d'une nuit. Lorsque ces moustiques se sont nourris du sang de personnes atteintes de paludisme, la bactérie a bloqué le développement du parasite chez ces personnes, comme elle l'avait fait en laboratoire.
Contrairement à certaines bactéries intestinales, D. tsuruhatensis TC1 ne se transmet pas d'un moustique à l'autre. Bien que cela puisse constituer une limitation à terme, c'est un avantage du point de vue de la sécurité, et cela pourrait faciliter l'obtention de l'autorisation réglementaire pour son utilisation à large échelle. Des études sont actuellement en cours pour poursuivre le développement d'un outil de lutte contre le paludisme basé sur la bactérie D. tsuruhatensis, qui pourrait être utilisée en conjonction avec les stratégies existantes pour parvenir à l'éradication mondiale du paludisme.
A suivre…
Date de dernière mise à jour : 23/03/2024
Ajouter un commentaire
