Sclérose en plaques et EBV
Sclérose en plaque et virus Epstein-Barr
Résumé tout public
La sclérose en plaques est une maladie auto-immune
qui touche près de 3 millions de personnes dans le monde
Dans cette maladie, la myéline qui constitue la gaine isolante des cellules nerveuses du cerveau et de la moelle épinière est attaquée et endommagée par le système immunitaire de l'hôte. Les lésions résultantes altèrent la communication entre les neurones et engendrent de nombreux symptômes physiques et mentaux.
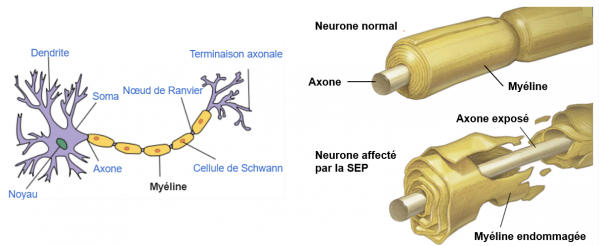
A gauche schéma d’un neurone. A droite détails sur la sclérose en plaques (SEP). La myéline constituée de lipides (entre 70 et 85%) et de protéines (dont la GlialCAM, voir plus loin) s’enroule autour de l’axone des neurones permettant son isolation et favorisant la transmission de l’influx nerveux. Un certain nombre de maladies (sclérose en plaques, polynévrite, maladie de Charcot-Marie-Tooth, syndrome de Guillain-Barré, etc.) résultent d’affections démyélinisantes ou impliquant la myéline. (Adapté de Wikipedia et Mayo Foundation).
Deux formes principales de la maladie existent : la forme rémittente, qui évolue par poussées, caractérisées par l’apparition de troubles en quelques jours pouvant régresser complètement ou non en quelques semaines, et la forme progressive, dépourvue de poussées et qui évolue peu à peu.
Selon la plupart des chercheurs qui étudient la sclérose en plaques, les facteurs responsables de la maladie sont extérieurs au système nerveux central. Mais deux thèses s'affrontent au sujet des facteurs déterminants de la maladie : auto-immunité contre virus Epstein-Barr.
Découvert en 1964, le virus Epstein-Barr infecte environ 90% de la population mondiale. Ce virus provoque chez certaines personnes une mononucléose infectieuse généralement bénigne. Dans l'organisme, il infecte les cellules épithéliales qui tapissent la surface de la gorge, ce qui lui permet de se transmettre à d'autres personnes par la salive, d'où l'expression "maladie du baiser" pour caractériser la mononucléose qui en résulte. Le virus infecte également les lymphocytes B, qui constituent un réservoir au sein duquel il entre en "hibernation". Ainsi, le virus Epstein-Barr persiste dans l'organisme et peut causer des problèmes longtemps après l'infection initiale.
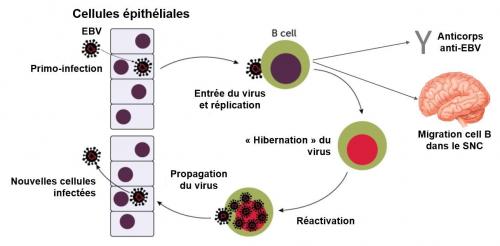
Infection, réplication, hibernation, réactivation et propagation du virus Epstein-Barr. Les cellules épithéliales tapissent l'intérieur de la bouche, du tube digestif, des vaisseaux sanguins, des poumons, de la vessie, etc. Elles sont souvent la porte d'entrée dans le corps des virus et autres microorganismes. EBV: virus Epstein-Barr. B cell: lymphocyte B; ces cellules sont productrices d'anticorps symbolisés par la lettre Y. Les cellules B peuvent migrer dans le système nerveux central (SNC) où elles activent la maladie (voir plus loin). Adapté de Science News 2022.
On suspecte depuis le début des années 2000 que la sclérose en plaques pourrait être la conséquence d'une infection par le virus Epstein-Barr. En effet, les personnes qui ont fait une mononucléose sont davantage susceptibles de développer une sclérose en plaques ou des cancers tels que le lymphome de Hodgkin par rapport à celles qui n'ont pas fait de mononucléose. Cependant, des liens directs entre le virus et la maladie restaient hypothétiques.
L'année 2022 a été déterminante pour la compréhension
du rôle direct et causal du virus Epstein-Barr dans l'étiologie de la sclérose en plaques
Deux articles majeurs ont permis cette avancée :
- Une étude longitudinale rétrospective (Bjornevik et al. 2022) a été conduite sur une cohorte multiethnique constituée de dix millions d’adultes jeunes en service actif au sein de l’armée des Etats-Unis. Une prise de sang effectuée tous les deux ans entre 1993 et 2013 chez les participants a permis de constituer une large banque de données, avec plus de 62 millions de prélèvements permettant de documenter en fonction du temps : i) la présence du virus Epstein-Barr (marqueurs sérologiques) et ii) la présence de la sclérose en plaques (marqueurs biologiques). Sur les 801 cas de sclérose en plaques détectés, un seul cas est survenu chez un participant dont la sérologie virale était négative au terme du suivi. Cette étude établit que le virus Epstein-Barr est le principal agent causal de la sclérose en plaques.
- Dans une autre étude (Lanz et al. 2022) les chercheurs ont examiné des anticorps obtenus à partir du liquide céphalo-rachidien (liquide qui baigne le cerveau) de personnes atteintes de sclérose en plaques et ont identifié des anticorps qui reconnaissent de petites régions de protéines (antigènes) correspondant à des protéines du virus d'Epstein-Barr. Jusque-là rien d'anormal. Mais ils ont ensuite découvert que ces anticorps reconnaissent également la protéine GlialCAM, un composant des cellules gliales du cerveau responsables de la production de myéline. Ce résultat indique que GlialCAM peut servir de cible à ces anticorps, fournissant un "auto-antigène" pour l'auto-immunité responsable de la sclérose en plaque, schématisée dans la figure ci-dessous.
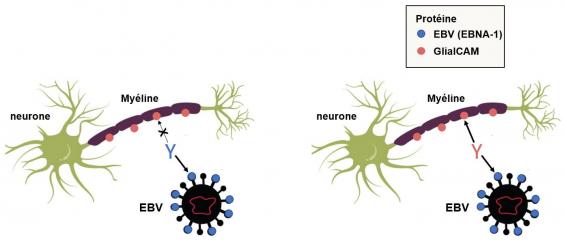
Conclusion de l'étude de Lanz et al. Dans un premier temps (image de gauche), le système immunitaire produit des anticorps contre le virus Epstein-Barr (EBV) symbolisés par la lettre Y bleue. Ces anticorps attaquent seulement la protéine virale EBNA-1 schématisée par un cercle bleu. Après pénétration dans le cerveau (image de droite), les lymphocytes subissent un processus complexe d'hypermutation somatique à l'issu duquel, au lieu de produire uniquement des anticorps contre le virus d'Epstein-Barr, ils produisent des anticorps symbolisés par la lettre Y rouge présentant une réactivité croisée contre la protéine virale EBNA-1 ET la protéine intra cérébrale GlialCAM présente dans la myéline. D'où le déclenchement de la maladie. Adapté de Science News 2022.
Conclusion
Les données cliniques impliquent maintenant un coupable viral et un dysfonctionnement du système immunitaire comme facteurs sous-jacents de la sclérose en plaques.
La compréhension des mécanismes cellulaires et moléculaires qui conduisent au développement de cette maladie devrait contribuer à la mise au point de nouvelles thérapies: vaccin anti-virus Epstein-Barr, inactivation des lymphocytes B résidants dans le cerveau, antiviraux qui ciblant le virus Epstein-Barr.
Pour aller plus loin
L'infection par le virus Epstein-Barr (EBV) est depuis longtemps suspectée comme un facteur déclenchant de la sclérose en plaques (SEP). Des analyses antérieures ont montré une augmentation des anticorps sériques dirigés contre l'EBV chez ~99,5 % des patients atteints de SEP, contre ~94 % chez les personnes en bonne santé (Ascherio, Ann. Neurol. 2007).
L'année 2022 a été déterminante pour la compréhension du rôle direct et causal du virus Epstein-Barr dans l'étiologie de la sclérose en plaques
Deux articles majeurs ont permis cette avancée: Bjornevik et al. Science 2022 et Lanz et al. Nature 2022.
Bjornevik et al. ont testé l'hypothèse selon laquelle la sclérose en plaques (SEP) est causée par le virus Epstein-Barr (EBV). En se basant sur une cohorte multiethnique comprenant plus de 10 millions de jeunes adultes hommes et femmes en service actif dans l'armée américaine sur une période de 20 ans (1993-2013), ces chercheurs ont analysé: i) les anticorps anti-EBV et ii) un marqueur biologique de la SEP présents dans le sérum des participants, en fonction du temps. Ils ont trouvé que 801 personnes avaient développé une SEP durant la période d'étude. Trente-cinq des 801 cas de SEP étaient initialement séronégatifs pour l'EBV, et 34 ont été infectés par l'EBV avant l'apparition de la SEP. La séropositivité à l'EBV était presque omniprésente au moment du développement de la SEP, un seul des 801 cas de SEP étant séronégatif à l'EBV au moment de l'apparition de la SEP. Le risque de SEP était multiplié par 32 après une infection par l'EBV, mais n'était pas augmenté après une infection par d'autres virus, y compris le cytomégalovirus, qui se transmet de la même manière. Les taux sériques de la chaîne légère des neurofilaments, un biomarqueur de la dégénérescence neuro axonale, n'ont augmenté qu'après la séroconversion au virus EBV. Ces résultats fournissent des données convaincantes qui impliquent l'EBV comme déclencheur du développement de la SEP.
Cependant, une question reste sans réponse. Comment un virus à tropisme pour les cellules B se transforme-t-il en responsable d'une maladie du système nerveux central?
La SEP se manifeste par une attaque inflammatoire contre la gaine de myéline et les axones qu'elle isole. Au final, les neurones eux-mêmes sont lésés. D'où la maladie. Diverses études ont identifié des cellules B infectées par l'EBV dans le cerveau de patients atteints de SEP (Moreno et al., Neurol. Neuroimmunol. Neuroinflamm. 2018; Serafini et al., J. Virol. 2019). Les cellules B et leur progéniture activée, les plasmablastes, expriment l'intégrine a4, dont les propriétés adhésives permettent: i) le passage de la moelle osseuse à la circulation périphérique, ii) la traversée de la barrière hémato-encéphalique, puis iii) leur installation à l'intérieur du cerveau et de sa paroi interne (Lanz et al. Nature 2022).
Une caractéristique distincte de la SEP est la synthèse d'immunoglobulines par des lignées clonales de plasmablastes dans le cerveau
Lorsque ces immunoglobulines, présentes dans le liquide céphalo-rachidien (LCR, qui baigne le système nerveux central) de patients atteints de SEP, sont analysées sur un gel d'électrophorèse, on observe des bandes de mobilité restreinte, appelées Bandes d'immunoglobulines Oligo Clonales (BOC), représentant les lignées clonales des plasmablastes. Ces immunoglobulines, issues d'un processus appelé hypermutation somatique sont très abondantes dans le LCR des malades atteints de SEP.
Comme viennent de le montrer Lanz et al., ces immunoglobulines (anticorps) ciblent les cellules gliales productrices de myéline, et les endommagent. Ces auteurs ont mis à jour un mimétisme moléculaire de haute affinité entre un facteur de transcription de l'EBV, la protéine EBNA-1, et la protéine gliale GlialCAM présente dans la myéline du SNC et exprimée par les astrocytes et les oligodendrocytes. Afin de fournir des preuves structurelles et fonctionnelles in vivo de ce phénomène, ils ont examiné des anticorps obtenus à partir du liquide céphalo-rachidien (LCR) de personnes atteintes de SEP. Un anticorps monoclonal à réaction croisée dérivé du LCR (MS39p2w174) ciblant la région EBNA-1 AA386-405 (motif PPRRPP) a été tout d'abord identifié par séquençage unicellulaire du répertoire des cellules B du sang et du LCR chez des personnes atteintes de SEP. Puis un test sur des anticorps dérivés du LCR exprimés par recombinaison contre les protéines de l'EBV a été réalisé. L'analyse des séquences, les mesures d'affinité et la structure cristalline de l'épitope peptidique de EBNA-1 en complexe avec le fragment Fab auto réactif ont permis de suivre le développement de l'anticorps naïf restreint à l'EBNA-1 vers un anticorps mature à réaction croisée entre la protéine virale EBNA-1 et la protéine gliale GlialCAM qui contient en position 370-389 un motif PPRAPS proche de celui de la protéine ENBA-1. Le mimétisme moléculaire est facilité par une modification post-traductionnelle de GlialCAM (phosphorylation).
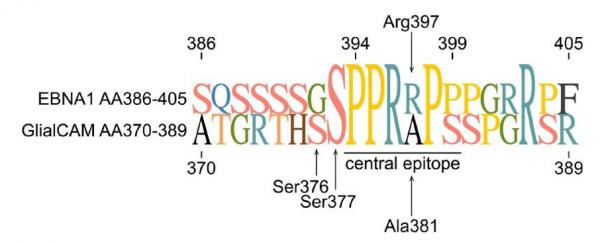
La séquence en acides aminés des deux protéines EBNA1 et GlialCAM est présentée ici dans la forme à une lettre (chaque lettre représente un acide aminé) dans les régions 386-405 et 370-389, respectivement. La séquence de l'épitope central reconnue par l'anticorps MS39p2w174 sur les protéines EBNA-1 et GlialCAM est soulignée. Il s'agit du motif PPRRPP (proline-proline-arginine-arginine-proline-proline) pour EBNA1 et PPRAPS (proline-proline-arginine-alanine-proline-sérine) pour GlialCAM. (Lanz et al. 2022).
Comme attendu, dans un modèle murin de la SEP, l'immunisation par EBNA-1 exacerbe les manifestations pathologiques de la maladie en augmentant la quantité des anticorps qui reconnaissent la cible cérébrale GlialCAM. De plus, des anticorps anti-EBNA-1/GlialCAM sont prévalents chez les patients atteints de SEP. Ces résultats fournissent un lien mécanistique pour l'association entre la SEP et l'EBV, et pourraient guider le développement de nouvelles thérapies pour la SEP.
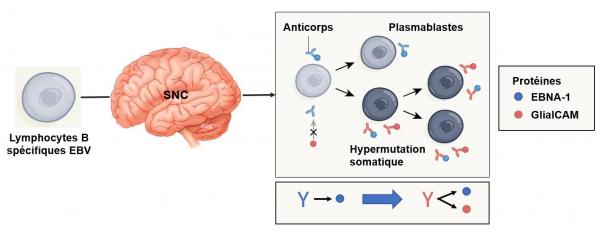
Après que les cellules B spécifiques à l'EBV entrent dans le cerveau, elles subissent un processus qui modifie la reconnaissance de la cible par les anticorps. Au cours de ce processus, la reconnaissance de l'antigène activerait les cellules et les amènerait à proliférer et à se différencier pour former des cellules productrices d'anticorps appelées plasmablastes. Les cellules B spécifiques de l'EBV dans le cerveau subissent un changement appelé "hypermutation somatique". Ce processus modifie la spécificité des anticorps comme par exemple la transformation d'un anticorps (bleu) qui reconnaît uniquement l'antigène EBV vers un anticorps (rouge) qui reconnaît les antigènes de l'EBV et d'une protéine du cerveau appelée GlialCAM. Le ciblage de la GlialCAM pourrait conduire à l'auto-immunité, qui est une caractéristique de la SEP. Adapté de Wekerle Nature 2022.
Ces données sont intrigantes et donneront certainement naissance à de nombreuses nouvelles pistes de recherche
Plusieurs questions restent posées. Où et comment se développe le processus d'hypermutation somatique dans le cerveau ? Ce processus nécessite généralement la présence de l'antigène ou des antigènes reconnus, l'aide des lymphocytes T auxiliaires correspondants et, idéalement, un microenvironnement favorable. Certaines de ces conditions préalables sont réunies dans le cerveau des personnes atteintes de SEP, notamment lorsque des agrégats anormaux de cellules B sont présents dans les compartiments cérébraux leptoméningés et périvasculaires. Ils peuvent contenir l'EBNA-1 et fournir un milieu approprié pour la différenciation des cellules B en plasmablastes. Des cellules T auxiliaires réagissant à l'EBNA-1 ont également été décrites dans la SEP, et certaines d'entre elles présentent une réaction croisée avec les peptides de la myéline (Wekerle, Nature 2022; Robinson Science 2022).
L'infection par l'EBV est probablement nécessaire, mais pas suffisante, pour déclencher le développement de la SEP
Presque toute la population mondiale est infectée par l'EBV, mais seule une petite fraction développe une SEP. Ainsi, d'autres facteurs, tels que la susceptibilité génétique, sont importants dans la pathogenèse de la SEP. Certains gènes, tels que ceux qui codent pour les protéines HLA (human leukocyte antigen-presenting), déterminent la partie d'une protéine qui est présentée au système immunitaire. D'autres gènes contrôlent les modifications des protéines associées à l'EBV, notamment la phosphorylation. Ces gènes sont essentiels pour moduler le mimétisme moléculaire responsable de l'auto-immunité et de la maladie (Lanz et al. Nature 2022; Tengvall et al., PNAS 2019).
Prévention et traitements de la SEP
Cet ensemble de résultats montre le rôle déterminant de l'EBV dans l'étiologie de la SEP. Cela pourrait amener de nouvelles possibilités de prévention et de traitement. Un vaccin contre l'EBV (déjà en cours de production) protégerait-il contre la SEP ? Les cellules B qui résident dans le LCR peuvent-elles être tuées ou inactivées par des traitements ? Les antiviraux qui ciblent l'EBV pourraient-ils constituer un traitement efficace, surtout lorsqu'ils sont administrés au début de l'évolution de la maladie ?
A suivre…
Date de dernière mise à jour : 12/01/2023
Ajouter un commentaire
