IMMUNOLOGIE
L'IMMUNOLOGIE POUR LES NON SPECIALISTES
Ce texte, comme tous ceux publiés sur ce site, est basé sur mes analyses personnelles de publications scientifiques ou médicales publiées dans des revues internationales anglophones à comité de lecture. Ces publications sont référencées sur le format suivant: premier auteur, nom de la revue, année de parution. Chacune d'entre elles est accessible (soit le résumé, soit l'article entier) via un lien PubMed.
Prologue
Il existe une blague que les chercheurs se racontent pendant les pauses café durant les congrès en immunologie. C'est la blague du cardiologue et de l'immunologiste, rapportée par le Dr. Jessica Metcalf (photo ci-dessous), Immunologiste, Université de Princeton, USA.
 Un terroriste prend deux éminents chercheurs en otages, l'un est cardiologue et l'autre est immunologiste.
Un terroriste prend deux éminents chercheurs en otages, l'un est cardiologue et l'autre est immunologiste.
Son but est de tuer l'un des deux, mais en réalité, il ne sait pas lequel.
Alors il leur dit :
- Je vais vous questionner sur votre activité professionnelle et je verrai lequel d'entre vous deux est le plus méritant et je l’épargnerai.
Les deux chercheurs se regardent avec angoisse et acquiescent.
Le terroriste commence par le cardiologue :
- Qu'avez-vous fait de bien dans votre vie ?
- Eh bien, je me suis intéressé à cet organe vital qu'est le cœur. J'ai étudié son anatomie, toutes ses fonctions et j'ai travaillé sur des médicaments qui permettent d'en guérir les pathologies. Cela a permis de sauver la vie de millions de personnes.
Le terroriste (très impressionné) :
- Oui, c'est vraiment bien ce que vous avez fait.
Il se retourne alors vers l'immunologiste et demande :
- Et vous alors, qu'avez-vous fait de votre vie ?
- Eh bien, je me suis intéressé au système immunitaire. Mais voyez-vous ce système est très, très, très compliqué. Je vais vous expliquer comment il fonctionne…
Le cardiologue se met alors à hurler :
- Pitié ! Par pitié, tuez-moi tout de suite !
Le fait est que le système immunitaire est très compliqué
Si vous avez du mal à comprendre son fonctionnement ne soyez pas honteux. L'immunologie confond même les chercheurs et médecins les plus chevronnés qui ne sont pas spécialistes de cette discipline - d'où la blague de Jessica Metcalf. Je fais moi-même partie de ces non spécialistes du système immunitaire, ce qui m'a valu de nombreuses migraines…
Je me suis alors dit qu'il serait utile de rédiger un document qui permettrait d'expliquer son fonctionnement en termes simples et abordables par les non spécialistes. Afin de garder ce texte plus "lisible", je me suis volontairement cantonné aux principaux acteurs (cellules, systèmes immunitaires, cytokines), en impassant les aspects plus moléculaires (fracteurs transcriptionnels et voies de signalisation) qui m'auraient amené à aborder d'autres concepts faisant appel à une spécialisation plus étroite. Je demande donc humblement par avance aux spécialistes en immunologie qui tomberaient sur ce texte de bien vouloir être indulgents.
Le système immunitaire est sans nul doute le système du corps humain le plus complexe, après le cerveau
Il s'agit d'un réseau biologique extrêmement étendu de cellules, de gènes et de protéines qui nous protègent des virus, bactéries et autres pathogènes. Les divers composants de ce système communiquent entre eux, se transforment, se mobilisent, s'amplifient, s'associent ou au contraire s'opposent les uns aux autres.
Déjà, à lui seul le terme "immunité" crée la confusion
- Dans l'esprit des immunologistes il signifie simplement que le système immunitaire a réagi à un pathogène, par exemple en produisant des anticorps ou en générant des cellules cytotoxiques défensives.
- Dans l'esprit du grand public, il est associé à l'idée d'une protection contre une infection.
- Les politiques et diplomates quant à eux l'utilisent assez fréquemment, quoique rarement au sujet d'une infection pathogène.
Cependant, une réponse immunitaire ne confère pas nécessairement une protection. Tout dépend de son efficacité, de la quantité et de la durée de vie des lymphocytes cytotoxiques, des anticorps, des caractéristiques de l'agent pathogène et des cellules du système immunitaire mis en jeu.
L'immunité est donc généralement une question de degré, et non d'absolu.
Résumé tout public
Les trois phases de la réponse immunitaire
Schématiquement, le système immunitaire se développe sur trois phases.
Première phase : l'immunité innée, les généralistes
Cette première phase consiste à :
- Détecter une menace représentée par un agent pathogène (virus, bactérie, champignon, parasite),
- Appeler à l'aide via les médiateurs de l’inflammation
- Lancer la contre-attaque.
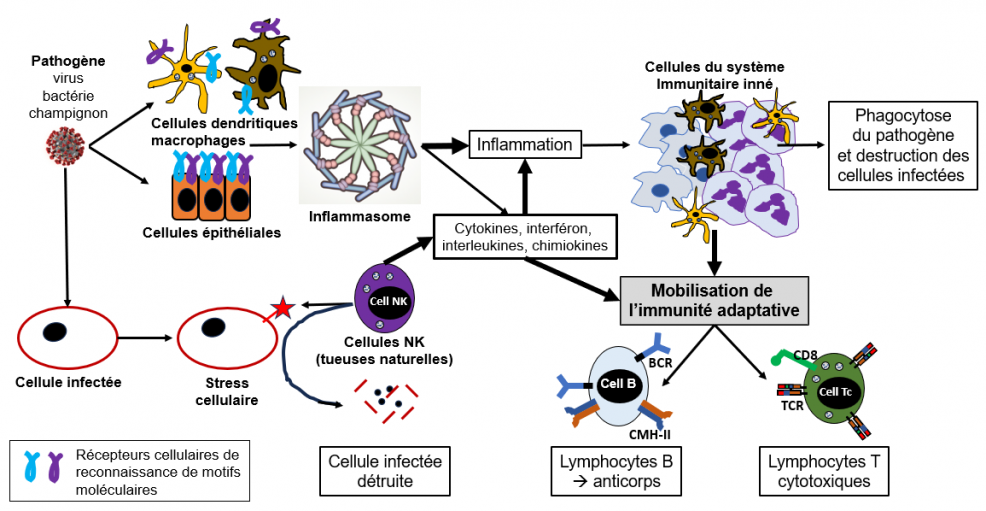
Figure 1 : l’immunité innée
L'immunité innée commence dès qu'un agent pathogène s'aventure dans les cellules de l’organisme, soient dans les leucocytes (cellules dendritiques, macrophages, monocytes, granulocytes, lymphocytes tueurs naturels, etc.) qui patrouillent continuellement dans le sang et la lymphe, soient dans les cellules épithéliales des barrières naturelles (peau, voies respiratoires, tractus digestif, muqueuses). Cette immunité innée commence par la reconnaissance du pathogène et son "étiquetage" comme étant étranger à l'organisme grâce à tout un arsenal de récepteurs codés par notre génome. Ces récepteurs dits "de reconnaissance de motif moléculaire", sont des protéines présentes à la surface des cellules mentionnées ci-dessus. Ils représentent l’élément déterminant dans la formation des inflammasomes au sein de chaque cellule infectée. Les inflammasomes constituent la première étape de l’immunité innée qui génère une réponse pro-inflammatoire afin de réparer les dommages causés à l'hôte par le pathogène. L’inflammasome est un complexe multiprotéique d’au moins trois constituants, le récepteur de reconnaissance de motif moléculaire déjà mentionné ci-dessus, une protéine adaptatrice et une caspase (protéine capable de cliver d’autres protéines pour les activer). C’est ainsi que l’inflammasome conduit à la production de diverses cytokines qui initient le processus d’inflammation (recrutement des cellules du système immunitaire sur le lieu de l’attaque, destruction du pathogène, destruction des cellules lésées par le pathogène, etc.). Comme on le verra plus bas, cet arsenal de cellules immunitaires et de cytokines va permettre la mobilisation de l’immunité adaptative médiée par les lymphocytes B et T. Un autre type cellulaire qui participe activement à l'immunité innée sont les cellules dites NK (pour natural killer, en anglais) ou cellules tueuses naturelles. Ces cellules sont capables de reconnaître les signaux de stress (étoile rouge sur la figure) émis par les cellules infectées (par exemple des cellules de poumon, lors d'une infection COVID-19), et de détruire ces cellules. Les mots en gras, sont définis de façon plus détaillée dans le chapitre LES ACTEURS (voir plus loin).
Le système immunitaire inné présente les caractéristiques suivantes:
- Il est rapide et s'active dans les minutes qui suivent l'entrée du pathogène ou la perception d'un stress.
- Il est ancien (en termes d'évolution des espèces) et utilise des composants que partagent la plupart des animaux.
- Il est générique et agit de la même manière chez tous les individus.
- Il est large, s'attaquant à tout ce qui semble à la fois "non humain" et dangereux, sans trop se soucier de savoir quel agent pathogène spécifique est en cause.
- Ce que le système immunitaire inné manque en précision, il le compense en rapidité.
Souvent l'infection s'arrête là, avec la disparition du pathogène.
Cependant, si cette première phase échoue, l’immunité innée lance alors la contre-attaque par mobilisation de l’immunité adaptative représentée par les "spécialistes" que sont les lymphocytes T et B. Cette mobilisation se fait par l'intermédiaire des cellules dendritiques, des macrophages et tout un ensemble de cytokines (Clark & Kupper, J Invest Dermatol 2005).
Deuxième phase : l'immunité adaptative, les spécialistes
Contrairement à la réponse innée, la mise en place de cette réponse adaptative nécessite du temps (plusieurs jours au minimum). Ce temps est nécessaire à la fabrication des cellules immunitaires principales, les lymphocytes T et B. La spécialisation et la flexibilité de cette réponse adaptative sont assurées par la manière unique dont les lymphocytes T et B reconnaissent les antigènes, c'est à dire des motifs moléculaires spécifiques portés par le pathogène (par exemple, les parties de la protéine S du SARS-CoV-2). Contrairement aux cellules du système inné qui utilisent un répertoire fixe de récepteurs codés par des gènes, les gènes qui codent pour les récepteurs d'antigènes subissent dans cellules T et B une recombinaison ("un mélange") qui va permettre de créer des récepteurs antigéniques nouveaux et uniques, capables de reconnaître n'importe quel antigène (plusieurs milliers de milliards !).
Les caractéristiques de la réponse immunitaire adaptative sont spécialisation, flexibilité et mémoire. Schématiquement, les lymphocytes T cytotoxiques sont des tueurs de pathogènes qu'ils reconnaissent via leurs récepteurs antigéniques. Les lymphocytes B quant à eux agissent en libérant des anticorps dont le rôle est de reconnaître l'antigène et le détruire (Clark & Kupper, J Invest Dermatol 2005).
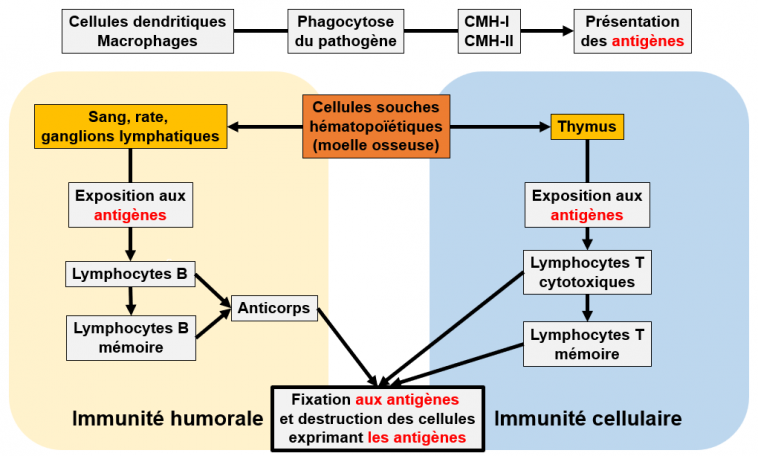
Figure 2 : l’immunité adaptative
Parmi les cellules du système immunitaire (les leucocytes), les cellules dendritiques et les macrophages jouent un rôle central. Ces cellules expriment les complexes majeurs d’histocompatibilité de types I et II (CMH-I et CMH-II). En phagocytant le pathogène, elles le réduisent en petits fragments (peptides de quelques acides aminés ou autres molécules, appelés antigènes et épitopes) et ces fragments sont reconnus par les CMH-I et CMH-II qui les transportent jusque sur la membrane des cellules où ils sont exposés aux cellules du système immunitaire. On qualifie souvent de ce fait les cellules dendritiques et les macrophages de cellules "présentatrices professionnelles" des antigènes. En patrouillant dans le sang et la lymphe qui baignent l’ensemble de l’organisme, ces cellules présentent les antigènes à toutes les cellules du système immunitaire issues des cellules souches hématopoïétiques de la moelle osseuse. Les cellules souches qui passent par le sang, la rate, la lymphe et les ganglions lymphatiques vont se différencier en lymphocytes B après qu’elles aient été présentées aux antigènes portés par les CMH-I et CMH-II. Les cellules souches qui passent par le thymus vont se différencier en lymphocytes T (T pour thymus) après qu’elles aient été présentées aux antigènes portés par les CMH-I et CMH-II. Les lymphocytes B sont capables de reconnaître des milliards d’antigènes différents contre lesquels ils produisent des anticorps spécifiques. Ces lymphocytes B vont également se stocker dans l’organisme sous forme de lymphocytes B mémoires, pour réapparaître dès que le pathogène contre lequel ils ont été initiés attaquera l’organisme. Les lymphocytes T sont capables de reconnaître des milliards d’antigènes différents qu’ils vont cibler à la surface des cellules infectées par le pathogène et les détruire, d’où le qualificatif de "cytotoxique". De même, ces lymphocytes T cytotoxiques vont se stocker dans l’organisme sous forme de lymphocytes T cytotoxiques mémoires, pour réapparaître dès que le pathogène contre lequel ils ont été initiés attaquera l’organisme. On distingue ainsi deux types d’immunité adaptative, l’immunité humorale médiée par les lymphocytes B, et l’immunité cellulaire médiée par les lymphocytes T cytotoxiques. Les mots en gras, sont définis de façon plus détaillée dans le chapitre LES ACTEURS (voir plus loin).
Troisième phase : la phase de mémoire immunitaire
Les cellules B et T qui se sont spécialisées dans la reconnaissance d'un antigène issu d'un pathogène ne disparaissent pas de l’organisme, mais persistent à long terme et apportent des réponses rapides et spécifiques dès la réinfection par le même pathogène, un concept connu sous le nom de "mémoire immunologique". Cette phase, très importante, permet à l'organisme de garder quelques-uns des "spécialistes" (cellules T et cellules B) sous la main. Si le même virus ou la même bactérie attaque à nouveau, ces "cellules mémoire B et T" peuvent entrer en action immédiatement et lancer la réponse ciblée contre le pathogène sans les délais de plusieurs jours nécessaires à la mise en place de la phase adaptative. La mémoire est la base de l'immunité telle que nous la connaissons familièrement - une défense durable contre tous les pathogènes que nous avons précédemment rencontrés, soit par infection directe, soit par le biais de la vaccination (Palm & Henry, Frontier Immunol 2019 ; Mueller et al., Annu. Rev. Immunol. 2013).
Pour aller plus loin...
LES ACTEURS
Comment l'organisme distingue-t-il le soi du non-soi (les microorganismes pathogènes) ? Cette première question peut se doubler d'une deuxième : comment l'organisme fait-il pour que le système immunitaire ne s'attaque pas à ses propres cellules ? Il s'agit là d'un point déterminant pour la mise en place de l'immunité. Pour répondre à ces deux questions il faut s'intéresser au fonctionnement coordonné de divers acteurs : les pathogènes, les récepteurs de reconnaissance de motif moléculaire (ou de motifs moléculaires), les inflammasomes, les antigènes et épitopes, le complexe majeur d'histocompatibilité (système HLA), et les lymphocytes T et B.
Les pathogènes
On estime à l'heure actuelle qu'il existe environ 1400 pathogènes pour l'espèce humaine. Ces pathogènes sont les bactéries, les virus, les champignons, les parasites. Ils font leur entrée dans l'organisme par la peau, les muqueuses respiratoires, intestinales, et uro-génitales. A l'intérieur des tissus, ces pathogènes sont phagocytés par les cellules locales résidentes telles que les cellules dendritiques et les antigènes qui en dérivent sont "présentés" aux autres cellules du système immunitaire (voir plus loin). Ces cellules migrent vers les organes lymphoïdes secondaires locaux ganglions lymphatiques) via les vaisseaux lymphatiques. Par ailleurs, certains pathogènes pénètrent directement dans les vaisseaux lymphatiques et s'écoulent vers les ganglions lymphatiques locaux où ils sont capturés par des macrophages empêchant la propagation systémique de l'agent pathogène. De même, les agents pathogènes qui atteignent la circulation sanguine sont capturés par les macrophages locaux ou les cellules dendritiques dans la rate (Mueller et al. Annu Rev Immunol 2013).
Les antigènes et épitopes
Un antigène (désigné Ag, générateur d'anticorps) est une molécule ou une structure moléculaire présente sur un agent pathogène (bactérie, virus, parasite, etc.). Les antigènes les plus courants sont les polysaccharides, les glycolipides, les acides nucléiques (ADN, ARN) et les protéines. Les anticorps spécifiques ou les récepteurs d'antigènes des lymphocytes T et B (voir plus loin) sont capables de se lier à ces macromolécules ou structures moléculaires. C'est la présence d'antigènes de l’envahisseur qui déclenche dans l'organisme une réponse immunitaire.
Un épitope ou déterminant antigénique, est la partie d'un antigène spécifiquement reconnue par les acteurs du système immunitaire, anticorps, lymphocytes T ou lymphocytes B. L'épitope est le morceau spécifique de l'antigène auquel un récepteur lymphocytaire ou un anticorps va se lier. Dans la figure ci-dessous, des exemples d'épitopes de la protéine S (Spike) du SARS-CoV-2 responsable de la COVID-19 sont présentés (Voss et al. JCIinsight 2021).
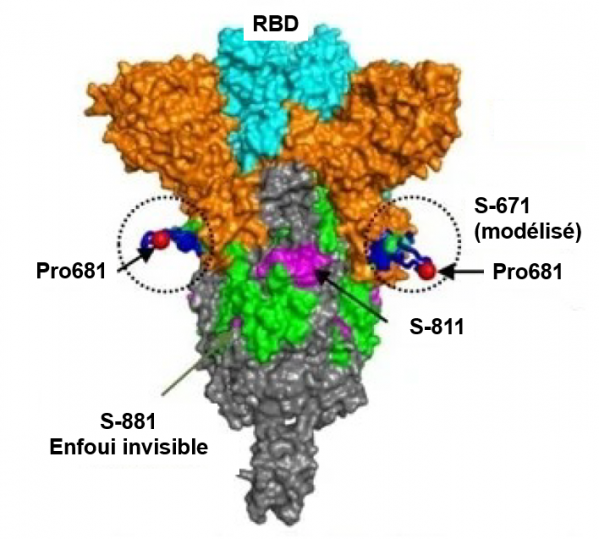
Figure 3. Structure modélisée de la protéine Spike du SARS-CoV-2 (variant B.1.1.7) montrant l'emplacement de certains épitopes critiques
La protéine S (trimère) qui tapisse la surface de la membrane virale est un des plus puissants antigènes du virus. RBD (Receptor Binding Domain) indique la position du site de liaison au récepteur cellulaire ACE-2. La position de 3 épitopes, S-671, S-811 et S-881 (enfoui invisible) est indiquée sur le modèle. L’acide aminé proline en position 681 (Pro681) qui fait partie de l’épitope S-671 est représenté par une sphère rouge. A noter que dans le variant B.1.1.7., cette proline remplace une histidine (His681) dans le variant SARS-CoV-2 original (Wuhan 2019). De ce fait, les anticorps de malades ayant été infectés par le variant original ne reconnaissent pas l’épitope S-671 du variant B.1.1.7. présenté ici. Il en est de même pour tous les variants qui apparaissent durant l'évolution du virus. Cette figure est adaptée de la publication de Voss et al. JCIinsight 2021.
La partie de l'anticorps qui se lie à l'épitope est appelée le paratope. Bien que les épitopes soient généralement issus de protéines étrangères (issues du non soi), les molécules ou une structures moléculaires dérivées de l'hôte qui peuvent être reconnues dans le cas des maladies auto-immunes sont également appelées des épitopes. Qu'ils soient situés sur des polysaccharides, des glycolipides, des acides nucléiques (ADN, ARN) ou des protéines, les épitopes sont divisés en deux catégories, les épitopes conformationnels (qui ont une structure en 3-D) et les épitopes linéaires (séquence d'acides aminés par exemple), selon le mode d'interaction qu'ils utilisent pour se lier au paratope. Une même molécule étrangère peut présenter un grand nombre d'épitopes différents comme le montre la table ci-dessous.
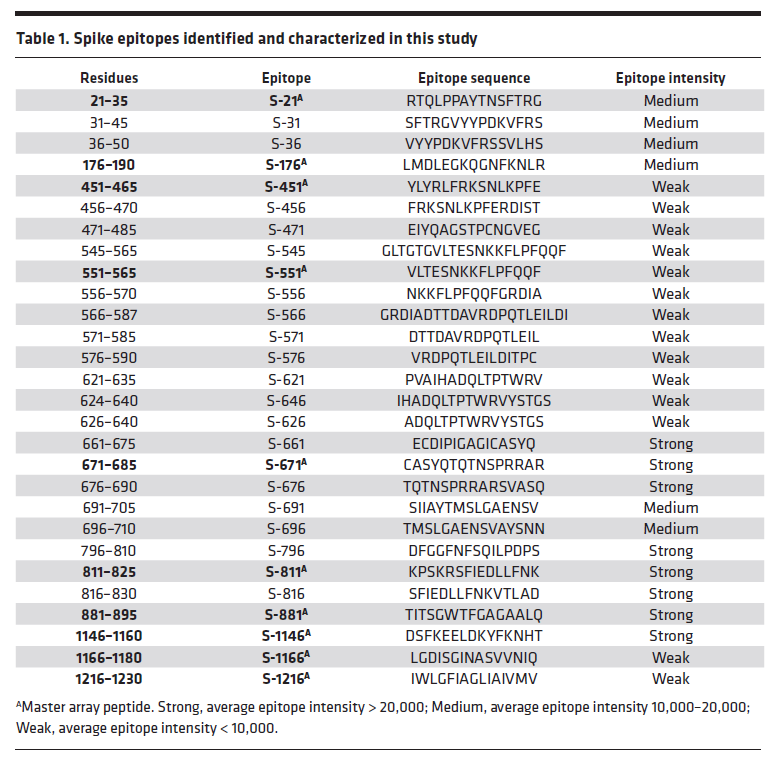
Table 1. Exemples d’épitopes différents présents sur la protéine S du variant SARS-CoV-2 B.1.1.7.
Residues (1ère colonne) indique la position de l’épitope sur la protéine; par exemple le premier épitope S-21 est situé entre les acides aminés 21 et 35 de la protéine. La séquence acides aminés des épitopes est donnée (3ème colonne) dans le code à une lettre (chaque lettre représente un acide aminé, exemple A: alanine, L: leucine, etc.). L’intensité de la liaison des anticorps sur leur épitope donnée en 4ème colonne, a été mesurée comme forte (strong), moyenne (medium) ou faible (weak). (Résultats tirés de la publication de Voss et al. JCIinsight 2021).
Ainsi par exemple, après une infection par le SARS-CoV-2 un grand nombre d'anticorps sont produits contre les diverses protéines du virus. Chacun de ces anticorps est produit par une lignée spécifique de lymphocytes B. Toute lignée spécifique de lymphocyte B produit un anticorps spécifique dirigé contre un épitope spécifique de l'agent pathogène (dans l'exemple ci-dessus, le SARS-CoV-2). Un anticorps spécifique d'un épitope donné, relatif à un agent pathogène donné, est un anticorps monoclonal, c'est à dire issu d'une seule et unique lignée de lymphocytes B (Nelson et al. Mol Pathol 2000).
Les récepteurs de reconnaissance de motif moléculaire
Ces récepteurs jouent un rôle crucial dans le fonctionnement du système immunitaire inné. Ce sont des protéines exprimées sur les membranes externes ou à l'intérieur des leucocytes (ensemble des cellules du système immunitaire) ainsi que par les cellules épithéliales constituant une couche protectrice tapissant les surfaces internes des vaisseaux sanguins et les surfaces externes et internes des organes. Il existe plusieurs sous-groupes de ces récepteurs qui sont classés suivant le motif (ligand) reconnu, leur fonction, et leur localisation membranaire ou cytoplasmique (Rumpret et al. J Exp Med 2022).
Les récepteurs de reconnaissance de motif moléculaire ont la capacité de détecter les motifs moléculaires typiques associés aux pathogènes microbiens tels que les glucides bactériens (lipopolysaccharide, mannose), les acides nucléiques (ADN ou ARN bactérien ou viral), les peptides bactériens (flagelline, facteurs d'élongation des microtubules) et beaucoup d'autres molécules ou protéines. Après s'être fixés aux agents pathogènes, ces récepteurs de reconnaissance de motif moléculaire déclenchent un processus de digestion ou de destruction de l’agent pathogène initié par l'activation des inflammasomes. Ce processus se poursuit par la libération de cytokines pro-inflammatoires dont le but est de recruter sur le site de l'infection les autres cellules du système immunitaire.
Les inflammasomes
Dans le système immunitaire inné, les inflammasomes constituent la première ligne de défense de l'hôte en réponse à une infection, à un cancer, à des troubles métaboliques ou à une agression physique sévère. Les inflammasomes sont des complexes multiprotéiques hétérogènes présents dans les cellules du système immunitaire et les cellules épithéliales (formant les barrières naturelles). Ils sont constitués essentiellement de trois entités : i) un récepteur de reconnaissance de motif moléculaire (qui est différent selon la nature du pathogène), ii) une protéine de liaison entre ce récepteur et la caspase-1, appelée ACS, et iii) la caspase-1. Les caspases sont des protéines qui clivent d’autres protéines non bioactives afin de les rendre bioactives. Elles sont notamment impliquées dans le processus d’apoptose (mort cellulaire programmée). La caspase-1 des inflammasomes permet la production de cytokines pro-inflammatoires telle que l’interleukine-1b (IL-1b, active) à partir de la pro-IL-1b (inactive), de l’interleukine-18 (IL-18) et d’une protéine appelée la gasdermine D. Après activation, la gasdernime D forme des polymères qui se déplacent vers la membrane des cellules et y forment une multitude de pores par lesquels la cellule se vide de son contenu et meurt par pyropoptose. Également ces pores permettent la libération de molécules diverses dont des cytokines, médiateurs de l’inflammation, et d’antigènes présents dans la cellule au moment de la pyropoptose (Jamilloux et Henry, Medecine/Sciences 2013; Barnett et al. Cell 2023; Deets & Vance Nature Immunol 2021).
Il existe différents types d’inflammasomes qui se forment à partir de différents récepteurs de reconnaissance de motif moléculaire, selon les pathogènes (virus, bactérie, champignon, etc.) ou la nature physique de la lésion cellulaire (blessures, choc, etc.) détectés par des récepteurs associés à des dommages moléculaires (libération extracellulaire d’ADN ou d’ATP, efflux de potassium, dysfonction des mitochondries, par exemple).
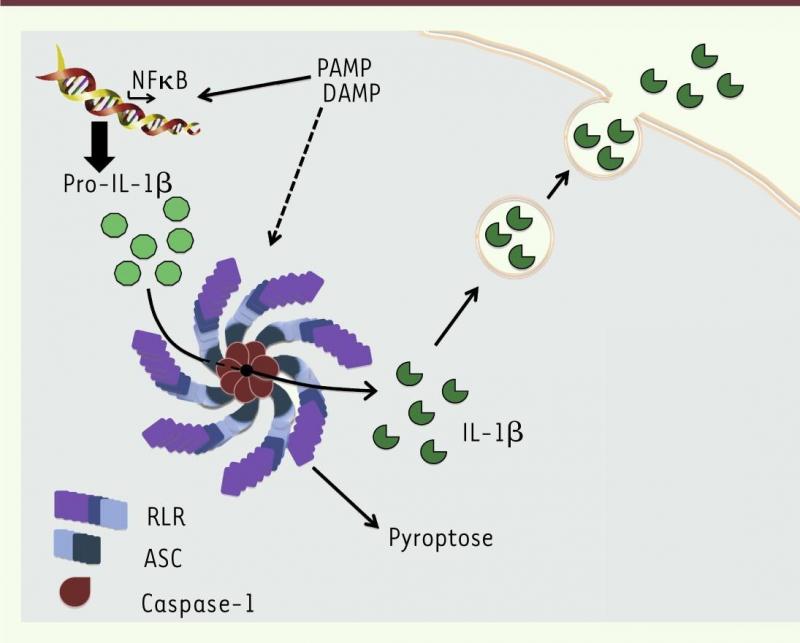
Figure 4. Exemple de fonctionnement de l’inflammasome NLRP3
Après activation par les divers récepteurs de reconnaissance de motif moléculaire (DAMP, signal de danger et PAMP signal microbien) l’inflammasome se constitue par interaction entre le récepteur NLRP3 (RLR), l’adaptateur ASC et l’effecteur, la caspase-1. L’activation des récepteurs DAMP ou PAMP induit la production de la pro-IL-1b (induite par le facteur transcriptionnel NFkB), qui est transformée en sa forme bioactive, l’IL-1 b, par la caspase-1 de l'inflammasome. L'IL-1b est ensuite sécrétée dans le milieu extracellulaire et va stimuler le processus inflammatoire. L’IL-18 jouera un rôle similaire. (Jamilloux et Henry, Medecine/Sciences 2013).
Il semble que la nature des inflammasomes dépende également du type de cellules dans lesquelles ils sont présents. On connait aujourd’hui au moins 8 types différents d’inflammasomes, NRLP1, CARD8, NRLP3, NLRP6, NIP/NLRC4, AIM2, Pyrin et caspase-4-5-11, dont au moins 3 ont été impliqués dans l’infection par le SARS-Cov-2, NLRP1, NLRP3 et AIM2 (Barnett 2023). Pour le moment, on ne sait pas avec précision comment l'activation de l'inflammasome interagit avec les signaux de maturation et de présentation d'antigènes par les cellules dendritiques et macrophages pour une présentation optimale aux cellules T.
L'inflammation
Nous avons vu ci-dessus que l’activation de l’inflammasome déclenche en aval une cascade pro-inflammatoire de cytokines qui conduit à une inflammation aigüe ou chronique (Ross, Annu Rev Immunol 2022). L’inflammation aigüe (par exemple en réponse à une infection virale) se traduit par l'apparition de rougeurs, chaleur, gonflement, douleur, autant de signes qui indiquent que le système immunitaire a été sollicité et qu’il est en train de se mettre en action. L'inflammation aiguë se produit immédiatement après l’infection et ne dure que quelques jours. Les cytokines pro-inflammatoires et les chimiokines favorisent la migration des leucocytes (neutrophiles et macrophages) vers le site de l'inflammation. Cette réponse inflammatoire aiguë nécessite une stimulation constante pour être maintenue car les médiateurs inflammatoires (interleukines, chimiokines et autres) ont une durée de vie courte et sont rapidement dégradés dans les tissus. Le processus d'inflammation stimule lui-même la production de cytokines par les leucocytes et notamment les interleukines IL-1b, IL-2, IL-6, IL-8, IL-12, IL-18, induites par diverses protéines de signalisation appelées TNFa (Tumor Necrosis Factor) et NFkB (Nuclear Factor kB) et impliquées dans le recrutement du complément, des neutrophiles et des cellules NK (Natural Killer, cellules tueuses naturelles). Dans le cadre d’une infection, l'inflammation aiguë cesse donc dès que le pathogène a été supprimé (Weinlich et al. Nature Reviews Mol Cell Biol, 2017 ; Chen et al., Oncotarget 2018 ; Davidovich et al., Biol Chem 2014 ).
A l’inverse, une inflammation chronique peut durer plusieurs mois ou années, en réponse à diverses agressions elles-mêmes chroniques, telles que le diabète, les maladies cardiovasculaires, des allergies, des maladies pulmonaires, des maladies neurodégénératives ou des cancers.
Les leucocytes
Ce sont les cellules de première ligne de défense de l'organisme (cellules dendritiques, macrophages) spécialisées dans la reconnaissance et la destruction des agents pathogènes (virus, bactéries, champignons, parasites) qui pourraient provoquer une infection. Elles sont localisées dans les barrières naturelles de l'organisme (peau, tube digestif, système respiratoire, barrière hématoencéphalique), dans le sang et la lymphe. Elles peuvent être divisées en deux classes, les granulocytes et les phagocytes (Liew et al., Physiol Rev 2019; Geissmann et al., Science 2010; Germic et al., Cell Death Differ, 2019; Vivier et al., Nat Immunol 2008).
Les granulocytes sont des "tueurs" de pathogènes. Ils comprennent les leucocytes neutrophiles, basophiles et éosinophiles, mastocytes. Ils sont caractérisés par la présence de granules spécifiques dans leur cytoplasme. Ces granules peuvent être comparés à des bombes cellulaires. Ce sont de petits sacs remplis de molécules antimicrobiennes comme les défensines et protéines cationiques éosinophiles, d'enzymes comme les hydrolases acides et le lysozyme, et de molécules toxiques comme l'oxyde nitrique, le superoxyde, le peroxyde d'hydrogène et les radicaux hydroxy. Toutes ces molécules et protéines cytotoxiques sont capables par leurs actions conjuguées de détruire tout agent pathogène envahisseur. La dégranulation est le processus par lequel ces cellules libèrent le contenu des granules afin de tuer ces agents pathogènes ou les cellules les contenant. La dégranulation est également utilisée par certains lymphocytes tels que les lymphocytes T cytotoxiques et les cellules tueuses naturelles (NK) (voir plus loin).
Les phagocytes sont des "mangeurs" de pathogènes et de cellules endommagées. Ils comprennent les cellules dendritiques, monocytes, polynucléaires neutrophiles et macrophages. Ces cellules ingèrent (par phagocytose) les particules étrangères nocives, les agents pathogènes et les cellules mortes ou mourantes.
Comment ces cellules reconnaissent-elles les agents pathogènes ?
Le complexe majeur d'histocompatibilité
Le complexe majeur d'histocompatibilité (CMH, également appelé système HLA, antigène leucocytaire humain) est une grande famille de gènes qui codent pour des protéines cellulaire appelées protéines CMH, essentielles pour le bon fonctionnement du système immunitaire et en particulier dans la reconnaissance du soi et du non-soi (Janeway et al. Immunobiology, 5th edition, 2001). Ces protéines ont la capacité de se lier à tout antigène issu de protéines, de macromolécules (ADN, ARN, polymères, etc.) ou d’autre origine biologique (sucres, lipides, toxine, etc.). Une fois l’antigène lié, la protéine du CMH migre dans la cellule vers la membrane afin d’y présenter sa prise (l’antigène sous forme d'épitope). Comme nous verrons plus loin, c’est cette présentation aux cellules du système immunitaire qui les amènera à se spécialiser vers la reconnaissance spécifique de l’antigène/épitope en question. Chez l'homme, le CMH est localisé sur le chromosome 6 et contient 224 gènes couvrant environ 4 millions de nucléotides (c'est à dire approximativement 4 cm de longueur de notre ADN sur ses 2 mètres de longueur totale). La famille des gènes du CMH est divisée en trois sous-groupes: le CMH de classe I (CMH-I), le CMH de classe II (CMH-II) et le CMH de classe III (CMH-III). Seuls les gènes et protéines CMH-I et CMH-II sont directement impliqués dans le fonctionnement du système immunitaire et en particulier dans la "présentation" des antigènes aux cellules du système immunitaire.
Ces gènes sont hautement polymorphes, c'est à dire qu'ils contiennent un grand nombre de mutations lorsqu'on compare leur séquence d'un individu à un autre. De ce fait, les protéines CMH présentent des séquences en acides aminés légèrement différentes, d'un individu à l'autre. Ces différences sont concentrées sur le site de liaison de l’antigène et les régions adjacentes qui établissent un contact direct avec le récepteur des lymphocytes T ou B. C'est ce polymorphisme génétique qui rend difficile le choix d'un donneur compatible lors des transplantations d'organe. Les bases de données de génétique humaine dénombrent 19031 allèles (allèle: version possible d'un même gène) de CMH-I et 7183 de CMH-II. Chaque individu possède un jeu de 6 allèles du CMH-I et de 8 allèles du CMH-II.
Protéines CMH-I
Dans toutes nos cellules il existe un système complexe multiprotéique appelé le protéasome. La fonction du protéasome est de dégrader les protéines de l'hôte en peptides (dont la longueur peut aller de 7 à 9 acides aminés) lorsqu'elles sont lésées ou défectueuses, ou lorsqu'il s'agit de protéines exogènes issues de pathogènes (virus, micro-organismes intracellulaires, etc.) ou d'allo-antigènes (protéines issues d'autres humains dans les cas de greffe d'organe). Les protéines du CMH-I sont exprimées dans toutes les cellules de l'organisme, y compris les neurones et les plaquettes. Seuls les globules rouges en sont dépourvus. Elles sont chargées de reconnaître les peptides (antigènes) générés par le protéasome, de les lier et de les transporter jusqu'à la surface externe des cellules afin de les "présenter" aux cellules du système immunitaire et en particulier aux lymphocytes T. S'il s'agit des auto-peptides dérivés du renouvellement des protéines de l'hôte, les lymphocytes T cytotoxiques ne seront pas mobilisés. En effet, au cours de leur développement, ces cellules ont été sélectionnées pour acquérir une reconnaissance des auto-antigènes du soi (de l’hôte humain) et les tolérer. En revanche, s'il s'agit de peptides dérivés de protéines exogènes (virus, micro-organismes, etc.), les lymphocytes T cytotoxiques détectent le peptide présenté par les protéines du CMH-I et s'activent pour détruire la cellule (Blees et al. Nature 2017; Hansen et al. Nature Rev Immunol 2009).

Figure 5. Schéma du fonctionnement du CMH-I
A gauche, l'élipse marron symbolise une cellule de poumon infectée par un virus. Le protéasome de la cellule réduit les protéines du virus en fragments symbolisés par les petits cercles de couleur bleue et rouge. Ces fragments se lient aux CMH-I qui les transportent sur la membrane de la cellule où ils sont "présentés" aux lymphocytes T (cellule de droite) exprimant le co-récepteur CD8. Après interaction entre le récepteur du lymphocyte T (TCR, voir plus loin) et le CMH-I lié à l'antigène, le lymphocyte T devient un lymphocyte Tc cytotoxique (cellule du centre) qui va détruire la cellule de poumon infectée par le virus. Pour plus de détails sur le mécanisme de cytotoxicité voir la figure 9A.
Protéines du CMH-II
Nous avons vu que les leucocytes innés et en particulier les cellules dendritiques et les macrophages, sont en première ligne dans la rencontre avec les agents pathogènes. Avec les lymphocytes B (voir plus loin) ces cellules sont les seules à exprimer les protéines CMH-I et CMH-II et cette caractéristique leur vaut la qualification de cellules présentatrices "professionnelles" d'antigènes. Elles phagocytent et digèrent les pathogènes, c'est à dire qu'elles les réduisent en fragments sous forme de peptides antigéniques dont la longueur peut aller de 13 à 17 acides aminés. Une fois produits, ces antigènes se fixent sur les protéines CMH-II et sont transportés à la surface des cellules dendritiques ou des macrophages. Les protéines CMH-II liées à l’antigène s'ancrent dans la membrane et "présentent" de dernier au système immunitaire et plus précisément aux lymphocytes T. En fait, le complexe protéine CMH-II-antigène interagit avec le récepteur des lymphocytes T (récepteur des cellules T) et ses corécepteurs pour optimiser l'interaction entre le récepteur des cellules T, l'antigène et la transduction du signal. Cette présentation permet aux cellules de se lier, de se reconnaître et de se tolérer (auto reconnaissance, ou reconnaissance du soi). Lors de cette liaison, les lymphocytes T doivent en principe tolérer les auto-antigènes (humains) c'est à dire ne pas se mobiliser contre eux. En revanche, lorsqu'ils sont exposés à des antigènes issus de pathogènes ou des allo-antigènes (issus d'autres humains dans les cas de greffe d'organe par exemple) ils s'activent et vont contribuer à la destruction des cellules porteuses du pathogène ou de l’antigène étranger. Des pathologies surviennent lorsque ce principe est perturbé par exemple dans les réactions auto-immunes. On sait que certaines molécules du CMH (HLA-B27 par exemple) augmentent le risque de maladies auto-immunes plus que d'autres, possiblement du fait de mécanismes impliquant une présentation aberrante de l'antigène ou une activation aberrante des cellules T (Jones et al. Nature Rev Immunol 2006; Roche et al. Nature Rev Immunol 2015).
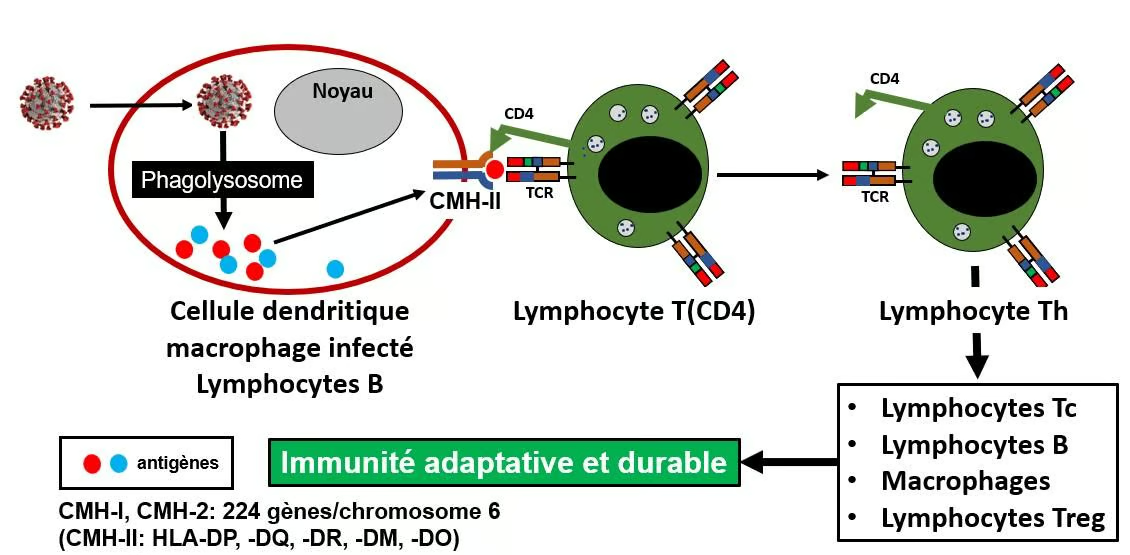
Figure 6. Schéma du fonctionnement du CMH-II
A gauche, l'élipse marron symbolise une cellule dendritique ou un macrophage infecté par un virus. Le phagolysosome de la cellule réduit les protéines du virus en fragments polypeptidiques symbolisés par les petits cercles de couleur bleus et rouges. Ces fragments se lient aux CMH-II qui les transportent sur la membrane de la cellule où ils sont "présentés" aux lymphocytes T (cellule de centre) exprimant le co-récepteur CD4. Après interaction entre le récepteur du lymphocyte T (TCR, voir plus loin) et le CMH-II lié à l'antigène, le lymphocyte T devient un lymphocyte Th dit "helper" (auxiliaire, cellule de droite). Les lymphocytes helpers vont permettre la fabrication des lymphocytes T cytotoxiques, des lymphocytes B producteurs d'anticorps, des macrophages, et d'autres types de lymphocytes dont les lymphcytes Treg, un ensemble de cellules qui va assurer l'immunité adaptative et durable.
Les cytokines
Ce sont de petites protéines (masse moléculaire entre 5 et 20 kDa) qui jouent un rôle majeur dans la signalisation cellulaire autocrine, paracrine et endocrine du système immunitaire. Les cytokines comprennent les chimiokines, les interférons, les interleukines, les lymphokines et les facteurs de nécrose tumorale. Elles sont distinctes des hormones ou des facteurs de croissance. Elles sont produites par une large gamme de cellules, notamment les cellules immunitaires, macrophages, lymphocytes B, lymphocytes T, mastocytes, mais aussi les cellules endothéliales, les fibroblastes et diverses cellules stromales (Dinarello, Chest 2000 ; Zhang et al. J Anesthesiol Clin 2007).
Une cytokine donnée peut être produite par plusieurs types de cellules. Etant donnée leur taille, les cytokines ne peuvent pénétrer dans les cellules et agissent donc en se fixant à des récepteurs spécifiques à la surface de leurs cellules cibles. Cette fixation conduit à l'activation de voies de signalisation intracellulaires qui aboutissent à la modulation de l'équilibre entre les réponses immunitaires humorales (anticorps) et cellulaires (lymphocytes T cytotoxiques), à la maturation, à la croissance et à la réactivité des populations cellulaires impliquées dans le système immunitaire.
Le job des cytokines est de recruter sur le lieu de l'infection les cellules les plus à même de combattre le pathogène, c'est à dire les phagocytes (macrophages) et les granulocytes (neutrophiles). Certaines cytokines accentuent ou inhibent l'action d'autres cytokines de manière complexe. Certaines agissent comme des alarmes, en convoquant et en activant une équipe diversifiée de leucocytes, phagocytes et granulocytes qui vont attaquer les pathogènes intrus - les avalant et les digérant (macrophages), les bombardant de produits chimiques destructeurs (granulocytes, lymphocytes T cytotoxiques), et libérant encore plus de cytokines. Certaines de ces cytokines empêchent aussi directement les virus de se reproduire. Ce sont les interférons qui mobilisent de nombreux gènes cellulaires antiviraux.
Les interférons
Les interférons (IFN) sont un groupe de protéines de signalisation produites et libérées par les cellules hôtes en réponse à une infection virale. Ils appartiennent à la grande classe des cytokines. Ils sont ainsi nommés pour leur capacité à "interférer" avec la réplication virale d’une part en protégeant les cellules, et d’autre part en les stimulant à renforcer leurs défenses contre ces infections. Cependant, les protéines codés par les virus ont la capacité de bloquer ou d'antagoniser la réponse IFN, ce qui contribue à la pathogenèse virale et aux maladies qui en résultent. Plus de vingt gènes et protéines IFN distincts ont été identifiés chez l'homme. En fonction du type de récepteur par lequel ils émettent un signal, les interférons humains ont été classés en trois grands types (Negishi et al. Cold Spring Harb Perspect Biol. 2018).
Interféron de type I : Tous les IFN de type I se lient à un complexe de récepteurs spécifiques de la surface cellulaire appelé IFN-α/β-récepteur (IFNAR) qui se compose des chaînes IFNAR1 et IFNAR2. Les interférons de type I présents chez l'homme sont les IFN-α, -β, -ε, κ et -ω. En général, ils sont produits par les fibroblastes et les monocytes lorsque l'organisme est infecté par un virus. Globalement, l'IFN-α peut être utilisé pour traiter les hépatites virales B et C, tandis que l'IFN-β peut être utilisé pour traiter la sclérose en plaques. (Ivashkiv et al. Nature Rev Immunol 2014)
Interféron de type II (IFN-γ chez l'homme) également connu sous le nom d'interféron immunitaire est activé par l'IL-12 et libéré par les cellules T cytotoxiques et les cellules T auxiliaires de type 1 (voir plus loin). L'IFN de type II se lie à l'IFNGR, qui se compose des chaînes IFNGR1 et IFNGR2 (Burke, Semin Immunol 2019).
Interféron de type III : il signale par l'intermédiaire d'un complexe de récepteurs composé de IL10R2 et IFNLR1. Bien que découvert plus récemment que les IFN de type I et II, des informations récentes démontrent l'importance des IFN de type III dans certains types d'infections virales ou fongiques (Lazear et al. Immunity 2019).
Les IFN ont également d'autres fonctions : ils activent les cellules immunitaires, telles que les cellules tueuses naturelles et les macrophages et ils augmentent les défenses de l'hôte en stimulant l'expression des complexe majeur d'histocompatibilité (CMH-I et CMH-II).
Le système du complément
Il s'agit d'un des systèmes de la phase immunitaire innée. Il est basé sur une série de protéines notées C1 à C9, synthétisées dans le foie et capables d'initier une cascade d'actions conduisant à l'opsonisation du pathogène avant même qu'une immunité adaptative ne soit mise en place. L'opsonisation d'un pathogène désigne l'action de diverses protéines (opsonines) de se fixer sur le pathogène afin de le "signaler" aux leucocytes tels que les macrophages et les neutrophiles qui se chargeront de sa destruction.
L'activation du complément se fait selon diverses voies. Dans la voie classique, le complexe C1 se fixe sur le pathogène présentant des motifs moléculaires spécifiques (appelés les PAMP, Pathogen Associated Molecular Pattern) particuliers n'appartenant pas au "soi", tels que par exemple les lipopolysaccharides sur des bactéries à Gram négatif. Un cascade de réactions impliquant les autres protéines du complément s'active alors pour conduire à la fixation de la protéine C3b sur le pathogène ce qui entraîne le recrutement des phagocytes, macrophages et neutrophiles.
Une autre voie d'activation du complément est la voie dite des lectines. Les lectines de liaison au mannose comme les pentaxines et les collectines sont capables de reconnaître certains types de glucides qui sont exprimés sur les membranes cellulaires des bactéries, champignons, virus et parasites, et peuvent agir comme opsonine en activant le système du complément et la phagocytose du pathogène.
Il existe enfin une autre voie du complément qui intervient dans l'immunité adaptative. Dans ce cas, le processus d'opsonisation est le même que celui décrit ci-dessus, à la différence que la protéine C3b se lie non plus au pathogène, mais aux régions Fc (région constante) des anticorps eux-mêmes, fixés sur le pathogène. Seuls les IgG1, IgG3, et les IgM, et plus faiblement les IgG2, sont capables d'entraîner la cascade des évènements conduisant à l'activation de la protéine C3b (Janeway et al., Immunobiology: The Immune System in Health and Disease. 5th edition, 2001; Nesargikar et al., European Journal of Microbiology & Immunology 2012; Stoermer et al., Virology, 2011).
Les cellules tueuses naturelles (NK)
Les cellules NK (Natural Killer en anglais) sont des cellules lymphoïdes effectrices innées, issues de la moelle osseuse. (Vivier et al. Nature 2024). Ces cellules jouent un rôle majeur dans l'immunité innée. Elles représentent environ 1 % du total des cellules du système immunitaires et 2 % du total des lymphocytes. Chez les individus sains, elles sont présentes principalement dans le foie, la moelle osseuse et le sang. Toute cellule infectée est stressée (modification de l’ADN, du métabolisme, de sa capacité à proliférer ou au contraire à ne pas proliférer, etc.) et émet des signaux dits de stress constitués par des protéines qui viennent se localiser à sa surface. La fonction des cellules NK est de reconnaître et d'éliminer directement ou indirectement les cellules « étiquetées » par ces signaux de stress tout en épargnant les cellules normales.
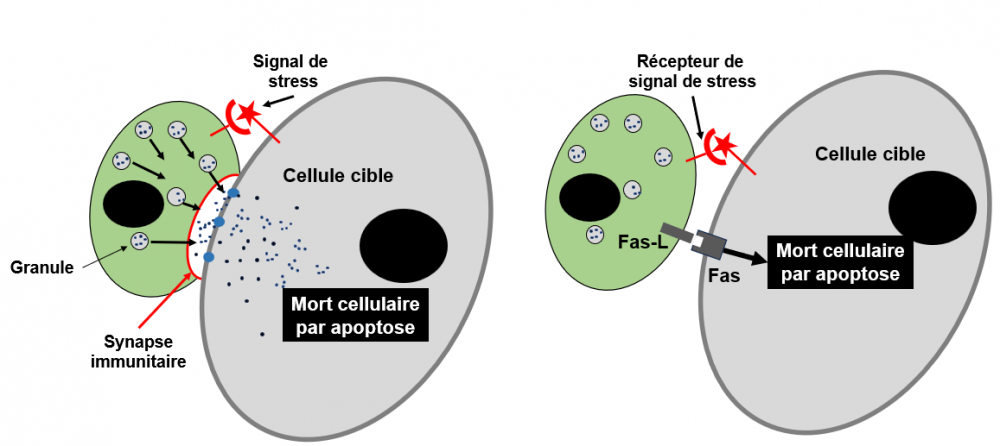
Figure 6A : Mécanisme d’action cytotoxique des cellules NK
Les cellules NK exercent leur action cytolytique selon deux voies différentes. Figure de gauche : la voie de l'exocytose des granules. Les granules sont des corpuscules cellulaires qui contiennent des molécules cytotoxiques comme la perforine et les granzymes, une famille de protéases. Lorsque la cellule NK s’est fixée sur sa cellule cible, il se forme une synapse immunitaire (en rouge) par laquelle transitent les granules vers la cible afin d’y libérer leur contenu (points noirs) via les pores (cercles bleus) produits par les perforines. Cette étape de dégranulation tue la cellule cible par apoptose. La synapse permet d'éviter la mort de la cellule NK elle-même dans ce processus. Figure de droite : la voies Fas-L/Fas. Fas-L (ligand de Fas) un membres de la famille des cytokines TNF, est exprimé par les cellules NK et régulés par l'IFN-g. Ce ligand est un important médiateur de l'apoptose par sa fixation sur le récepteur Fas exprimé sur les cellules cibles. Cette fixation active Fas dont l’action (non schématisée ici) conduit à la mort de la cellule cible par apoptose. Cette figure (très simplifiée) a été adaptée de Smyth et al., Mol Immunol 2005 et Rudd-Schmidt et al. Nature Communications 2019.
La grande majorité des cellules NK matures sont cytotoxiques, c’est à dire qu’elles détruisent les cellules qu’elles ciblent, soit par apoptose en déclenchant le processus de mort cellulaire programmée, soit par cytolyse, en libérant les enzymes et autres molécules toxiques contiennues dans leurs granules cytotoxiques (figure ci-dessus). Elles ont de plus une activité pro-inflammatoire importante par production d’un certain nombre de cytokines, notamment l’interféron-g, des facteurs de croissance et des chimiokines. La production de ces protéines pourrait exercer des effets anti-prolifératifs, anti-angiogéniques et pro-apoptotiques sur les cellules cancéreuses, ce qui pourrait contribuer à leur activité antitumorale.
Grâce à des protéines spécifiques qu’elles expriment sur leur membrane externe, les cellules NK peuvent également reconnaître leurs cibles cellulaires en se fixant directement sur les anticorps (émis par les lymphocytes B) préalablement fixés sur ces cellules infectées. On parle alors d’une cytotoxicité cellulaire dépendante des anticorps (Terunuma et al. International Reviews of Immunology, 2008).
Les spécialistes, les lymphocytes T et B
Lors d'une infection, les cellules dendritiques et les macrophages phagocytent l'agent pathogène (virus, bactéries, etc.) et le digèrent en petits fragments (par exemple antigènes protéiques de 13 à 17 acides aminés). Ces antigènes/épitopes se fixent sur les protéines du CMH-II qui les transportent à la surface des cellules afin de les "présenter" aux cellules du système immunitaire. A cette fin, les cellules dendritiques et macrophages se déplacent vers les ganglions lymphatiques, où des leucocytes hautement spécialisés - les lymphocytes T et les lymphocytes B - sont cantonnés et attendent. C'est là que les lymphocytes T et B qui expriment à leur surface des récepteurs capables de reconnaître spécifiquement les antigènes/épitopes portés par les CMH-II vont se cloner, proliférer et agir contre le pathogène en question.
Pour le système immunitaire, le challenge est de reconnaître des milliards d'antigènes potentiels auxquels l'organisme pourrait être exposé. Or, le génome humain ne contient que moins de 25 000 gènes différents. Il est donc impossible d'avoir un gène qui pourrait permettre de reconnaître chaque pathogène.
Comment l'organisme peut-il résoudre ce problème ?
Par le processus de recombinaison génétique somatique (voir plus loin), capable de créer de la diversité dans les récepteurs des lymphocytes T et les anticorps produits par les lymphocytes B (Tonegawa, Nature 1983; Hou et al., Genes & Immunity, 2016; Lefranc et al., Methods Mol Biol, 2018 ; Rees, Mabs, 2020).
Lymphocytes T
Les cellules T sont produites à partir de cellules souches hématopoïétiques, présentes dans la moelle osseuse. Lors de leur développement, ces cellules indifférenciées migrent via la circulation sanguine vers le thymus, organe au sein duquel elles vont commencer leur maturation, c'est à dire, acquérir leurs fonctions immunitaires spécifiques. C'est de cet organe que ces cellules tirent leur nom (cellules ou lymphocytes T, pour thymus). Durant leur séjour dans le thymus, les lymphocytes T subissent plusieurs étapes de différenciation au cours de processus très étroitement contrôlés (Taylor, New England J Medicine 2023).
Une première étape critique de la maturation des lymphocytes T consiste à fabriquer leur récepteur spécifique appelé "récepteur des cellules T" (ou TCR, "T Cell Receptor" en anglais, voir la figure ci-dessous). Le récepteur des cellules T qui s'exprime à la surface de ces cellules est capable de reconnaître une myriade d'antigènes. Ce récepteur est composé de deux chaînes protéiques différentes (c'est-à-dire qu'il s'agit d'un hétéro dimère) a et b dans 95% des cellules T et g et d dans les 5% restants.
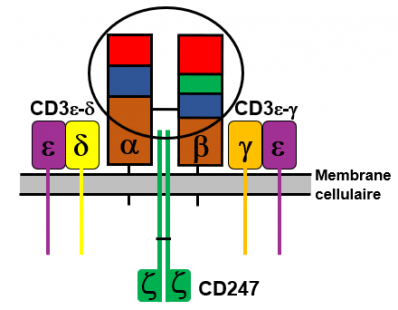
Figure 7. Schéma du récepteur des lymphocytes T
Le récepteur des lymphocytes T est un assemblage complexe de protéines intégré à la membrane de la cellule (zone grise), et la majeure partie de ce complexe s'étend à l'extérieur de la cellule (vers le haut de la figure). Le récepteur des cellules T fonctionnel est constitué de trois parties: le récepteur des cellules T proprement dit constitué de deux chaînes a et b dont la fonction est de reconnaître l'antigène, le CD3 constitué de deux hétérodimères (chaînes g et e et chaînes d et e) et enfin un homodimère de chaîne z (zeta) appelé aussi CD247. Les chaînes a et b du récepteur des cellules T (chaînes légère et lourde, respectivement) contiennent chacune deux domaines, un domaine constant (rectangle marron) et un domaine variable (rectangles rouge, bleu et vert entourés par un cercle noir). Les domaines variables des deux chaînes forment le site de liaison à l'antigène lorsqu'il est lié aux protéines du CMH-II à la surface des cellules présentatrices (cellules dendritiques ou macrophages), ou lorsqu'il est lié aux protéines du CMH-I à la surface de toutes les cellules infectées. Voir plus loin la figure : Recombinaisons génétiques et expression du récepteur des cellules T. Les deux autres constituants CD3 et l'homodimère z-z assurent la transmission du signal vers le noyau lorsque l'antigène a été reconnu. Ce signal indique à la cellule qu'elle doit mobiliser un certain nombre de gènes afin de se préparer à réagir, c'est à dire détruire une cellule infectée (cellule T cytotoxique) ou intervenir pour mobiliser d'autres cellules du système immunitaire (cellules T auxiliaires ou helpers). Chaque cellule T comporte entre 10 000 et 30 000 copies du même récepteur qui est spécifique d'un antigène donné à sa surface. Les protéines CD3 et z-z sont identiques sur toutes les cellules T.
Comment le récepteur des cellules T est-il fabriqué ?
Au sein du génome des lymphocytes T, l'ADN des gènes codant pour les protéines a et b qui constituent le récepteur des cellules T est soumis à un processus de recombinaisons V(D)J génétiques somatiques (Rees, Mabs 2020 ; Sadofsky, Nucl Acids Res 2001). Le terme somatique signifie que ces recombinaisons se font dans des cellules autres que les cellules embryonnaires ou sexuelles. Ces recombinaisons ne seront donc pas transmises à la descendance de l'hôte. Cette recombinaison génétique consiste à "mélanger/combiner" différents segments de gènes codant pour les différentes parties des protéines a et b qui constituent les récepteurs des lymphocytes T, situés respectivement sur les chromosomes 14 et 7. Ce sont ces recombinaisons génétiques qui confèrent aux lymphocytes T la capacité de reconnaître n'importe quel peptide antigénique présenté à la surface des cellules infectées.
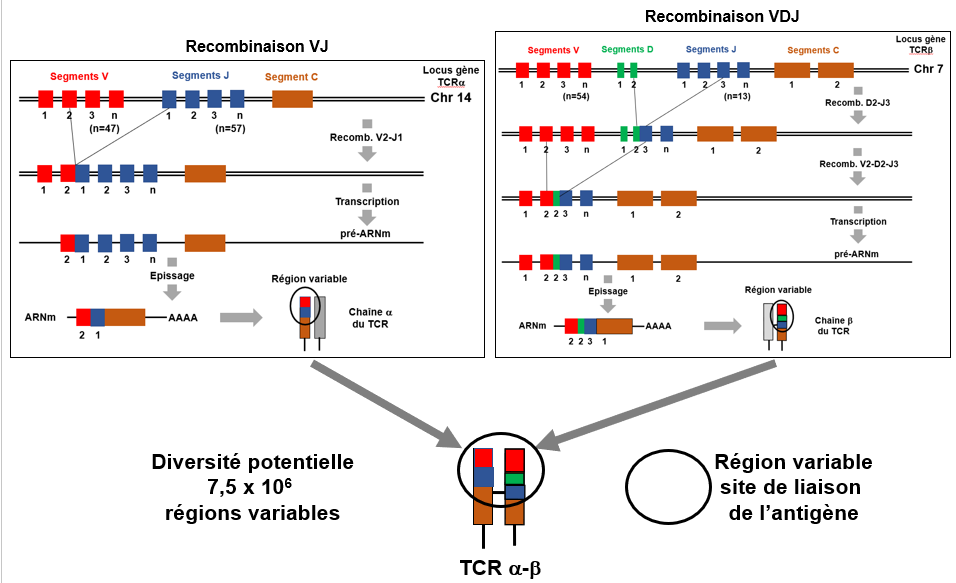
Figure 8. Recombinaisons génétiques et expression du récepteur des lymphocytes T
Partie gauche: chaîne a (chaîne légère) des récepteurs des cellules T. Le locus génétique du récepteur des cellules Ta situé sur le chromosome 14, est figuré par un double axe noir (ADN en double brin). Il est constitué de 47 segments V (exons codant pour la région variable, rectangles rouges), 57 segments J (région de jonction, rectangles bleus) et 1 segment C (région constante, rectangle marron) séparés par des introns (Mattia Cinelli, Thèse, University College of London, 2020). Noter que ce locus récepteur des cellules Ta ne contient pas de segment D. Lors du processus de recombinaison, non détaillé ici, les enzymes de recombinaison génétique RAG1 et RAG2 combinent les diverses segments V et J, un à un de façon aléatoire. Dans le schéma montré ici, la recombinaison V-J se fait sur les segments V2 et J1. Les exons et introns situés entre V2 et J1 sont éliminés. L'ARN polymérase ADN-dépendante génère le pré-ARN messager figuré par le trait noir (ARN simple brin). Ce pré-ARN messager est épissé (élimination des autres segments non fonctionnels et des introns et jonction entre l'exon V2J1 et le segment C) pour générer l'ARN messager codant pour le récepteur des cellules Ta. A noter la région poly A en position terminale. Cet ARN est traduit en protéine TCR chaîne a.
Partie droite: chaîne b (chaîne lourde) des récepteurs des cellules T. Le locus génétique du récepteur des cellules Tb situé sur le chromosome 7, est figuré par un double axe noir (ADN en double brin). Il est constitué de 54 segments V (exons codant pour la région variable, rectangles rouges), 2 segments D (région de diversité, rectangle vert), 13 segments J (régions de jonction, rectangles bleus) et 2 segments C (région constante, rectangle marron) séparés par des introns (Cinelli 2018). Dans le schéma montré ici, la recombinaison D-J se fait dans une première étape sur les segments D2 et J3. Les exons et introns situés entre D2 et J3 sont éliminés. Dans une deuxième étape, la recombinaison se fait entre l'exon D2J3 et le segment V2. L'ARN polymérase ADN-dépendante génère le pré-ARN messager figuré par le trait noir (ARN simple brin). Ce pré-ARN messager est épissé (élimination des autres segments non fonctionnels et des introns) pour générer l'ARN messager codant pour le récepteur des cellules Tb. Cet ARN est traduit en protéine TCR chaîne b.
Partie basse. On comprend que selon les segments V, D et J aléatoirement sélectionnés et assemblés, les protéines TCRa et TCRb seront différentes. Ce processus de recombinaison génétique se produit dans les cellules T en maturation dans le thymus. En tenant compte du nombre des segments V, D et J différents recombinés dans les locus récepteur des cellules T a et b, le nombre de régions variables différentes sur le récepteur dimérique (c'est à dire liant spécifiquement un antigène) est de l'ordre de 7,5x106.
En résumé donc, un récepteur de cellules T est constitué d'une chaine légère a et d'une chaine lourde b. La chaine b comporte trois segments V, D, et J qui constituent la région variable, c'est à dire la région liant spécifiquement un antigène. La chaine a comporte deux segments V et J qui constituent la région variable liant spécifiquement l'antigène. Les divers segments VDJ et VJ sont associés de façon aléatoire lors de la recombinaison génétique.
Ce sont ces recombinaisons génétiques qui confèrent aux récepteurs des cellules T cette extraordinaire capacité de reconnaître n'importe quel antigène invasif dont le nombre est estimé à plusieurs centaines de milliards.
Le calcul de la diversité potentielle disponible pour la population de cellules T périphériques porteuses du récepteur des cellules Ta-b via l'assemblage combinatoire de 47 segments V et 57 segments J et 1fragment C pour la chaîne a, et de 54 segments V, 13 segments J et 2 segments D et de 2 fragments C pour la chaîne b, le tout sans tenir compte de la diversité jonctionnelle, génère une diversité combinatoire de 7,5 × 106 récepteur des cellules T (paires a-b) (Mattia Cinelli, Thèse, University College of London, 2020). Cependant l’impact de la diversité jonctionnelle qui intervient durant le processus de recombinaison génétique fait passer ce nombre à un niveau de l’ordre de 1012 au moins (milliers de milliards).
Diversité jonctionnelle (Alberts et al. Molecular Biology of the Cell. 4th edition, 2002). Dans la plupart des cas de recombinaison spécifique à un site (voir la figure ci-dessus), la jonction de l'ADN est précise. Mais lors de la jonction des segments de gènes de récepteurs de cellules T ou d'anticorps (voir plus loin), un nombre variable de nucléotides est souvent perdu aux extrémités des segments de gènes recombinants, et un ou plusieurs nucléotides peuvent également être insérés au hasard. Cette perte et ce gain aléatoires de nucléotides aux sites de jonction sont appelés diversifications jonctionnelles et augmentent considérablement la diversité des séquences codantes de la région variable créées par recombinaison, en particulier dans la troisième région hypervariable. Cette diversification accrue a toutefois un prix. Dans de nombreux cas, elle entraîne un déplacement du cadre de lecture qui produit un gène non fonctionnel. Étant donné qu'environ deux réarrangements sur trois sont "non productifs" de cette manière, de nombreux lymphocytes T en développement ne produisent jamais de molécule de récepteur fonctionnelle et meurent donc dans le thymus. Les cellules T produisant des molécules de récepteurs fonctionnelles qui se lient fortement aux antigènes du soi sont stimulées pour réexprimer les protéines RAG1 et RAG2 (Recombination Activating Gene) et subissent une deuxième série de réarrangements V(D)J, modifiant ainsi la spécificité du récepteur de surface cellulaire qu'elles produisent - un processus appelé édition du récepteur (Sadofsky, Nucl Acids Res 2001). Les cellules T auto réactives qui ne parviennent pas à modifier leur spécificité de cette manière sont éliminées par le processus de suppression clonale.
Lorsque les cellules T se sont différenciées (cellules T matures) dans le thymus, elles quittent cet organe pour circuler dans le sang, la lymphe et les organes lymphoïdes secondaires (ganglions lymphatiques et rate). Avant d'avoir rencontré tout antigène elles sont dites cellules T "naïves" (CD4 et CD8).
Reconnaissance des protéines du CMH-I et du CMH-II
Une deuxième étape de la différenciation des lymphocytes T concerne leur capacité à reconnaître les protéines du CMH-I et du CMH-II et à acquérir une tolérance vis-à-vis des autoantigènes (protéines du soi) (Sun et al. Signal Transduction and Targeted Therapy, 2023 ; Rossjohn, Annu Rev Immunol 2015). Cette étape est essentielle et les lymphocytes T qui ne la satisfont pas sont détruits par apoptose. Pendant leur différenciation, les lymphocytes T se différencient du fait de l'expression de divers gènes codant pour des marqueurs (corécepteurs) importants comme les protéines membranaires CD4 et CD8 ainsi que pour des protéines d'adhésion et des protéines co-stimulatrices. Ces diverses molécules favorisent la liaison entre les cellules T et les CMH des cellules présentatrices d'antigènes. Alors que les lymphocytes T sont doublement négatifs pour CD4 et CD8 dans leur état indifférencié à leur arrivée dans le thymus, ils deviennent doublement positifs pour ces protéines et c'est l'intensité de l'interaction de leur récepteur avec les protéines du CMH-I et du CMH-II qui va décider de leur devenir. Ainsi les lymphocytes T dont le récepteur établit une forte liaison avec les CMH-I deviendront des cellules CD8+, l'expression de CD4 étant régulée à la baisse, tandis que les lymphocytes T dont le récepteur établit une forte liaison avec les CMH-II deviendront des cellules CD4+, l'expression de CD8 étant régulée à la baisse.
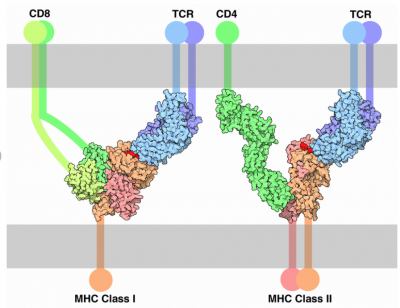
Figure 9. Interactions entre les TCR-CD8+ et -CD4+ et les CMH-I et CMH-II
Cette figure est à rapprocher des figures 5 et 6. En gris partie haute, la membrane du lymphocyte T, partie basse la membrane de la cellule présentatrice d'antigène ou infectée. Les molécules de CMH-I et -II sont en rose/orangé. les protéines CD4 et CD8 sont en vert clair et foncé. Le TCR est en bleu et mauve clair. L'antigène présenté par le CMH-I ou le CMH-II est en rouge (Mattia Cinelli, Thèse, University College of London, 2020).
Il existe donc deux types principaux de lymphocytes T matures : les lymphocytes T cytotoxiques (CD8+) et les lymphocytes T auxiliaires (CD4+), dits "helpers" en anglais.
Les lymphocytes T cytotoxiques sont des "tueurs". Ils vont détruire les cellules infectées et dans lesquelles l'agent pathogène est présent. On dit de ce fait que les lymphocytes T cytotoxiques sont impliqués dans la réponse immunitaire à médiation cellulaire. Les cellules T cytotoxiques CD8+ sont également capables d'utiliser des cytokines, pour recruter d'autres types de cellules lors de la mise en place d'une réponse immunitaire. Les lymphocytes T auxiliaires CD4+ quant à eux renforcent le système immunitaire, et en particulier ils contribuent à activer la production de lymphocytes T, de lymphocytes B producteurs d'anticorps et de macrophages (voir plus loin).
Un lymphocyte T peut compter jusqu'à 20 000 molécules de récepteurs antigéniques réparties à sa surface. Environ 98% des lymphocytes T meurent pendant les processus de différenciation dans le thymus. Seulement 2% d'entre eux survivent et quittent le thymus pour devenir des cellules T immunocompétentes matures. La régression du thymus liée à l'âge est associée à une diminution de la production de cellules T naïves. On considère que ce processus contribuerait à la réduction de la diversité des cellules T observée chez les personnes âgées et serait lié à une sensibilité accrue aux infections, aux maladies auto-immunes et aux cancers. L'involution thymique est l'un des changements les plus spectaculaires et omniprésents observés dans le système immunitaire vieillissant, mais les mécanismes qui sous-tendent ce processus sont encore mal compris.
Lymphocytes T cytotoxiques (dits Tc CD8+): Rencontre avec le CMH-I
Les cellules T présentant à leur surface une protéine corécepteur appelée CD8 (ils sont donc dits CD8+) vont se lier spécifiquement à l'antigène lorsqu'il est présenté par le CMH-I des cellules infectées par le pathogène. Cette rencontre déclenche la réponse cytotoxique, c'est à dire la "mise à mort" de la cellule infectée. Les cellules T cytotoxiques sont aussi mobilisées contre les cellules cancéreuses et les cellules transplantées (Sun et al. Signal Transduction and Targeted Therapy, 2023; Rossjohn, Annu Rev Immunol 2015).
Plusieurs mécanismes de destruction peuvent être utilisés par les lymphocytes T cytotoxiques.
- Libération de molécules formant des pores, comme les perforines.
- Libération du contenu de leurs granules cytotoxiques au site de contact cellule à cellule. Cela rend la membrane cellulaire de la cellule cible perméable, son contenu cellulaire s'échappe et la cellule meurt.
- En déclenchant une série d'événements avec la cellule cible qui active un programme de mort cellulaire, un processus appelé apoptose par activation d'une protéine de surface cellulaire appelée FAS. Lorsque FAS est activé, un signal est envoyé au noyau de la cellule cible, déclenchant le processus d'apoptose.
Du fait de ces divers mécanismes de destruction, la cellule cible meurt, détruisant ainsi le pathogène par lequel elle était infectée.
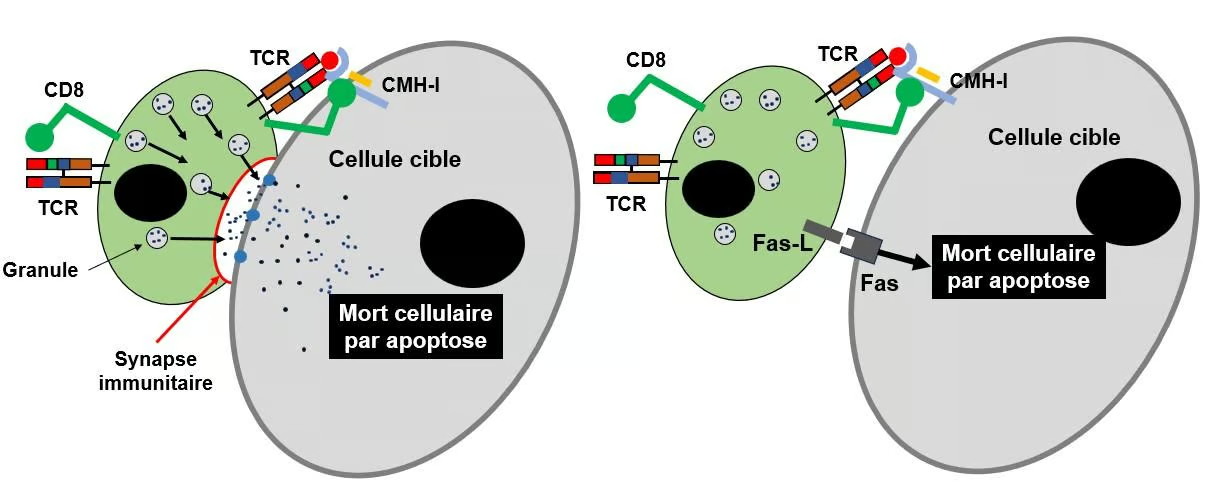
Figure 9A : Mécanisme d’action cytotoxique des lymphocytes Tc CD8+
Les lymphocytes T cytotoxiques CD8 exercent leur action cytolytique selon deux voies différentes. Figure de gauche : la voie de l'exocytose des granules. Les granules sont des corpuscules cellulaires qui contiennent des molécules cytotoxiques comme la perforine et les granzymes, une famille de protéases. Lorsque lymphocyte T cytotoxique (CD8+) dont le récepteur TCR interagit avec le complexe CMH-I-antigène (cercle rouge) s’est fixé sur sa cellule cible infectée, il se forme une synapse immunitaire (en rouge) par laquelle transitent les granules vers la cible afin d’y libérer leur contenu (points noirs) via les pores (cercles bleus) produits par les perforines. Cette étape de dégranulation tue la cellule cible par apoptose. La synapse permet d'éviter la mort du lymphocyte lui-même dans ce processus. Figure de droite : la voies Fas-L/Fas. Fas-L (ligand de Fas) un membres de la famille des cytokines TNF, est exprimé par lymphocytes T cytotoxiques et régulés par l'IFN-g. Ce ligand est un important médiateur de l'apoptose par sa fixation sur le récepteur Fas exprimé sur les cellules cibles. Cette fixation active Fas dont l’action (non schématisée ici) conduit à la mort de la cellule cible par apoptose. Cette figure (très simplifiée) a été adaptée de Smyth et al., Mol Immunol 2005 et Rudd-Schmidt et al. Nature Communications 2019).
Lymphocytes auxiliaires (dits CD4+): Rencontre avec le CMH-II
Cette rencontre a lieu dans les organes lymphatiques secondaires, ganglions lymphatiques et rate. Les cellules T CD4+ vont se lier spécifiquement à l'antigène lorsqu'il est présenté par le CMH-II des cellules infectées et présentatrices professionnelles de l'antigène, cellules dendritiques et macrophages (Yin et al. Annu Rev Immunol 2021). Excepté les lymphocytes T CD4+ CTL (voir plus bas), les lymphocytes T auxiliaires ne tuent pas directement les cellules infectées. Ils jouent cependant un rôle essentiel dans le système immunitaire adaptatif en favorisant l'activité, la suppression ou à la régulation d'autres cellules du système immunitaire. Ils sont essentiels dans l'activation et la croissance des cellules T cytotoxiques, dans le changement de classe des anticorps des cellules B, et dans la maximisation de l'activité bactéricide des phagocytes tels que les macrophages.
Divers types de cellules T auxiliaires (helper)
Il existe de nombreux pathogènes et de nombreux modes d'infection. Divers types de cellules T auxiliaires sont nécessaires pour éliminer ces différents pathogènes par la mise en place de réponses immunitaires différentes et adaptées. Les divers types de cellules T auxiliaires se différencient par la nature des cytokines qui régulent leur prolifération et qui leur permettent de communiquer avec les autres cellules du système immunitaire (Sun et al. Signal Transduction and Targeted Therapy 2023; van den Broek, Nature Rev Immunol 2018).
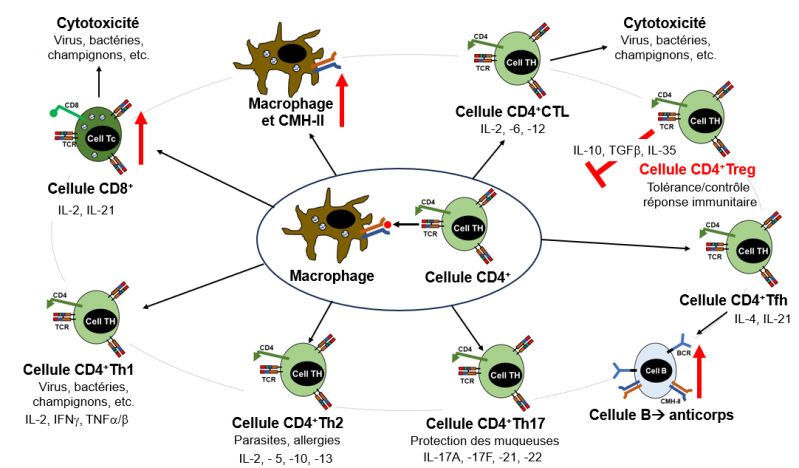
Figure 10. Lymphocytes T auxiliaires (helper)
Elipse centrale: rencontre entre un lymphocyte T CD4+ et le CMH-II d'un macrophage. Selon le contexte et l'environnement biologique (nature du pathogène, nature du tissus, nature des cytokines, chimioquines, facteurs transcriptionnels mis en jeu, etc.) diverses populations de lymphocytes T CD4+ vont être générées. Seules les cytokines impliquées dans ce processus sont montrées. A noter la population des CD4+ Treg (en rouge) qui joue un rôle régulateur négatif dans la réponse immunitaire. Ce rôle inhibiteur est figuré par le T rouge sur la figure (adaptée de Sun et al. Signal Transduction and Targeted Therapy 2023).
Cellules Th1. Elles sont caractérisées par la production de cytokines telles que l'IFN-γ, TNF-α/β et IL-2, et protègent l'organisme contre les pathogènes intracellulaires, bactéries, virus, chamignons et protozoaires (organismes unicellulaires constitués d'une seule cellule eucaryote parasite ou indépendante; exemples, amibes, trypanosomes, giardia un parasite intestinal). Les cellules Th1 sont impliquées dans les infections pulmonaires et jouent un rôle majeur contre le bacille de Koch (Mycobacterium tuberculosis), le virus de la grippe, le Staphylococcus aureus (S. aureus), et les coronavirus (Middle East respiratory syndrome coronavirus (MERS-CoV), et le SARS-CoV-2, responsable de la COVID-19.
Cellules Th2. Elles enclenchent une réponse immunitaire à médiation humorale dans les cas d'infection de l'organisme par des parasites extracellulaires (par exemple les helminthes) ou d'inflammations allergiques. Elles sont définies comme productrices d'interleukines IL-4, IL-5, IL-9, IL-10 et IL-13 qui stimulent la production d'IgE par les cellules B, la production de mastocytes et éosinophiles, et la production de mucus dans l'intestin. Les IgE se fixent sur la surface du parasite. Mastocytes et éosinophiles se lient sur les IgE et sécrètent le contenu de leur granules qui tuent le parasite immobilisé dans le mucus intestinal. Les cellules Th2 sont également importantes pour l'immunité des muqueuses pulmonaires.
Cellules Th17. Les lymphocytes Th17 sont caractérisés par une production massive de cytokines pro-inflammatoires (IL-17, IL-22, IL-23) et sont souvent mobilisés avec les cellules Th1 dans les infections fongiques, bactériennes (bacille de Koch, S. aureus) et virales (Hépatite B, et SARS-CoV-2 notamment). L'IL-17 recrutent les neutrophiles sur le site de l'infection. Ces cellules détruisent l'agent pathogène en relarguant le contenu de leurs granules. L'IL-22 stimule la production de peptides antimicrobiens dans les cellules épithéliales (cellules des bordures organisme-air, -lymphe, -sang, -cavité). L'IL-23 est la cytokine qui joue un rôle majeur dans la différenciation et la fonction des cellules Th17.
Cellules Tfh (foliculaire). Ces cellules sont essentielles pour la stimulation (via leur sécrétion d'IL-21) des cellules B qui produisent les anticorps contre les bactéries, champignons, parasite et virus. Par exemple dans l'infection par le SARS-CoV-2, la production de cellules Thf est très augmentée en particulier chez les malades convalescents et ceux qui présentent des symptomes légers. A l'inverse la réponse Thf est très diminuée ainsi que la production d'anticorps neutralisants chez les patients qui décèdent de cette infection. Les cellules Tfh sont largement impliquées dans la production des cellules B mémoires qui jouent un rôle majeur dans la réponse humorale lors d'une réinfection. Enfin ces cellules jouent également un rôle dans les tissus lymphoïdes mucosaux en promouvant la production d'IgA dans les infections qui touchent les voies respiratoires et digestives.
Cellules CD4+ CTL (Lymphocytes T Cytotoxiques), ou cellules CD4+ cytotoxiques. Ces cellules contribuent très directement à l'activité cytolitique dirigée contre le pathogène. De plus, on leur a récemment trouvé des fonctions intéressantes dans l'augmentation de la longévité, et la réduction de progression tumorale (Hashimoto et al. PNAS 2019 ; Poncette et al. Curr. Opin. Immunol. 2022). Les cellules CD4+ cytotoxiques ont été retrouvées à des niveaux élevés chez l'homme et la souris infectés par des virus HIV, HBV, HCV, HDV et SARS-CoV-2 (Hoeks et al. Front Immunol 2022). L'activité cytotoxique des cellules CD4+ est attribuée à l'expression de cytoquines pro-inflammatoires (IL-2, IL-6 et IL-12), à la perforine, aux granzymes A, B, K, H et M et à leur capacité de déclencher la mort cellulaire de leurs cellules cibles par apoptose. Aujourd'hui, il apparaît que les lymphocytes cytotoxiques CD4+ sont associés à l'immunité antivirale, mais également à une possible immunopathologie, notamment dans les infections par SARS-CoV-2 et la fibrose pulmonaire (Meckiff et al. Cell 2020 ; Kaneko et al. Clin Immunol 2022).
Cellules Treg (régulatoires). Ces cellules participent à la diminution de la réponse immunitaire, respectivement en stimulant leur propre production et en inhibant la fonction des macrophages (Hori, Nature Rev Immunol 2021; Plitas et al. Cancer Immunol Res 2016). Elles sont caractérisées par une forte expression du récepteur de l'IL-2 et de cytokines inhibitrices telles que IL-10, TGF-β, et IL-35. On distingue deux populations de ces cellules selon leur origine, celles qui dérivent du thymus (tTreg) et celles qui dérivent de la périphérie où elles sont induites (iTreg) après stimulation par un antigène en présence de TGF-β et IL-2. Ces cellules communiquent avec les autres cellules du système immunitaire et stoppent leur fonction lorsque l'infection initiale a été éradiquée. Cela permet deux choses: éviter la toxicité induite par le système immunitaire et éviter les réaction auto immunes.
En résumé, lorsqu'après maturation les lymphocytes T sortent du thymus pour rejoindre les ganglions lymphatiques, ils sont dotés de récepteurs uniques, chacun pouvant se lier à un antigène unique d'un agent pathogène et sont capables de moduler l'activité du système immunitaire en fonction des signaux fournis lors de leur rencontre avec les CMH-I et CMH-II des cellules présentatrices d'antigènes ou des cellules infectées. Pour tout nouveau virus (ou autre pathogène), il existe un lymphocyte T prêt à le combattre. Au moment où il est infecté, l'organisme n'a qu'une chose à faire, trouver et mobiliser ce lymphocyte.
On pourrait comparer les ganglions lymphatiques à des casernes remplies de mercenaires (les lymphocytes T), chacun d'eux reconnaissant une seule cible qu'il est prêt à combattre. La cellule messagère (cellule dendritique, macrophage) fait irruption dans la caserne avec une photo de l'agresseur qu'elle montre à chaque mercenaire en demandant : est-ce ta cible ? Lorsque la correspondance est trouvée, le mercenaire concerné se mobilise, s'arme, se clone en un bataillon entier, lequel s'élance sur le lieu du combat. Par exemple vers les voies aériennes dans le cas du SARS-CoV-2.
Les études en cours suggèrent que plusieurs types de lymphocytes T auxiliaires (helpers) peuvent être co-activées et agir en synergie durant une infection. Ainsi par exemple, une co-stimulation des cellules Th1, Th2 et Th17 est observée chez les malades atteints par la COVID-19 (Gupta et al., Natl Acad. Sci. Lett., 2022). Cependant, une réponse impliquant les cellules Th1 et des cytokines pro-inflammatoires peuvent causer des nécroses et fibroses pulmonaires, et une augmentation du niveau des cellules Th2 est associée une diminution de la réponse antivirale et une exacerbation de la sévérité de la maladie dans les infections SARS-CoV-2.
Lymphocytes B
Les lymphocytes B, également appelés cellules B, jouent un rôle majeur dans la composante humorale du système immunitaire adaptatif en produisant divers types d’anticorps. Chez l’homme, les lymphocytes B, dérivent des cellules souches hématopoïétiques qui prennent naissance dans la moelle osseuse et expriment des récepteurs d’antigènes (BCR, pour B Cell Receptors) sur leur membrane cellulaire. Voir la figure ci-dessous. Ces récepteurs BCR permettront aux cellules B de se lier à un antigène étranger, contre lequel elles déclencheront une réponse anticorps. Les récepteurs de cellules B sont extrêmement spécifiques, et tous les BCR d'une cellule B reconnaissant le même épitope.
Durant leur développement, les cellules B subissent 2 types de sélection liée à leur BCR. Une première est que les cellules B qui ne reconnaissent aucun ligand sont éliminées. Une seconde est que les cellules B qui reconnaissent les antigènes de l’hôte sont également éliminées. Les cellules B restantes présentent une tolérance totale vis-à-vis des antigènes spécifiques de l’hôte.
Après la maturation des cellules B dans la moelle osseuse par acquisition de leur BCR, elles migrent dans le sang vers les organes lymphoïdes secondaires tels que la rate et les ganglions lymphatiques, qui reçoivent un apport constant d'antigènes par le biais de la circulation lymphatique. L'activation du lymphocyte B commence lorsque le lymphocyte B se lie à un antigène par l'intermédiaire de son BCR.
Acquisition du récepteur des lymphocytes B
L'acquisition du récepteur des lymphocytes B est la première étape déterminante dans la différenciation ou maturation de ces cellules. Elle se produit dans la moelle osseuse.
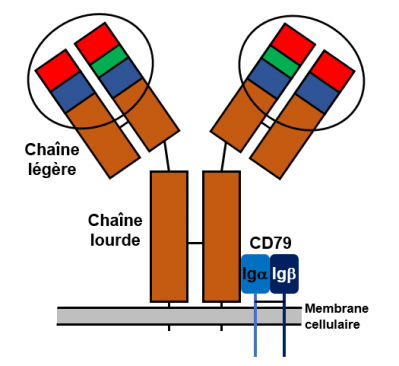
Figure 11. Le récepteur des lymphocytes B (BCR)
BCR est un complexe protéique localisé sur la surface extérieure de la membrane (partie grise) des lymphocytes B et constitué d'un anticorps transmembranaire et d'un dimère d'immunoglobulines Iga et Igb appelé CD79. L'anticorps transmembranaire est une protéine constituée de chaînes lourdes (parties ancrées dans la membrane) et légères d'immunoglobulines (parties externes des 2 branches du Y) comme dans un anticorps circulant. Les chaînes lourdes et légères sont liées par des ponts disulfures (S-S figurés par un trait d’union sur la figure). Ce récepteur possède un unique site de liaison antigénique déterminé aléatoirement du fait des recombinaisons génétiques V-(D)-J (voir ci-dessous). Il lie les antigènes circulants. Les 2 sites de liaison de l’antigène sont entourés d’un cercle noir. Chaque récepteur peut lier 2 antigènes. Cependant, à la différence des anticorps circulants classiques, le récepteur des cellules B possède une partie protéique transmembranaire et cytoplasmique qui permet son ancrage dans la membrane du lymphocyte B. De ce fait, le récepteur des cellules B est aussi appelé "immunoglobuline liée à la membrane". Les immunoglobulines impliquées dans les récepteur des cellules B sont des IgM et des IgD qui possèdent le même antigène spécifique cible. Les protéines Iga et Igb ne sont exprimées que dans les cellules B. L'activation de ces protéines se fait dès que les récepteurs des cellules B (IgM et IgD) lient un antigène. Leur rôle est de transmettre au noyau l'information selon laquelle le récepteur des cellules B s'est lié à un antigène. La cellule adapte alors son comportement (prolifération, différenciation, changement de classe) en activant tout une série de gènes spécifiques. Une cellule B typique humaine aurait entre 50 000 et 100 000 anticorps fixés sur sa surface.
Comment le récepteur des cellules B est-il fabriqué ?
Comme dans le cas des lymphocytes T (voir plus haut), au sein du génome des lymphocytes B l'ADN est soumis à un processus de recombinaisons génétiques somatiques. (Briney et al., Nature, 2019; Rees, Mabs 2020). Ces recombinaisons génétiques consistent à "mélanger/combiner" entre eux suivant un processus très complexe les différents gènes codant pour les différentes parties des chaines lourdes et légères des récepteurs des lymphocytes B, situés respectivement sur les chromosomes 14, et 2 et 22.
Ce sont ces recombinaisons génétiques qui confèrent aux récepteurs des lymphocytes B la capacité de reconnaître n'importe quel antigène rencontré ou présenté par les cellules du système immunitaire ou les cellules infectées, et qui confèrent aux anticorps produits par ces lymphocytes B la capacité de reconnaître une myriade d'antigènes (de l’ordre de plusieurs milliers de milliards).
Le calcul de la diversité potentielle disponible pour la population de cellules B périphériques via l'assemblage combinatoire de 51 gènes VH, 6 segments JH, 25 segments D pour les chaînes lourdes, et 50 gènes Vκ, avec 5 segments Jκ plus 50 gènes Vλ, et 7 segments Jλ pour les chaînes légères, le tout sans tenir compte de la diversité jonctionnelle, génère une diversité combinatoire "centrale" de 4,6 × 106 récepteur des cellules B (régions variables) .
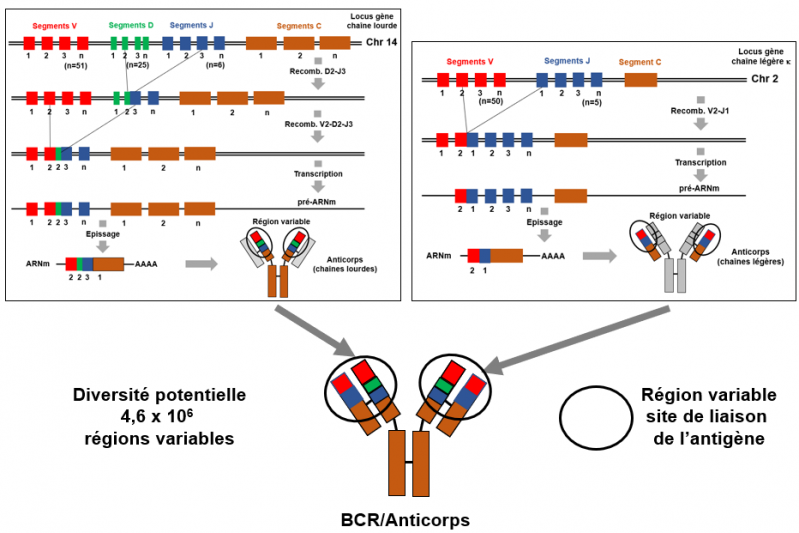
Figure 12. Recombinaisons génétiques et expression du récepteur des lymphocytes B
Partie gauche: chaîne lourde des récepteurs des cellules B. Le locus génétique du récepteur des cellules B situé sur le chromosome 14, est figuré par un double axe noir (ADN en double brin). Il est constitué de 51 segments V (exons codant pour la région variable, rectangles rouges), 25 segments D, 6 segments J (région de jonction, rectangles bleus) et 3 segments C (région constante, rectangle marron) séparés par des introns. Lors du processus de recombinaison, non détaillé ici, les enzymes de recombinaison génétique RAG1 et RAG2 combinent les diverses segments V-D-J, un à un de façon aléatoire. Dans le schéma montré ici, la recombinaison V-D-J-C se fait sur les segments V2, D2, J3 et C1. L'ARN polymérase ADN-dépendante génère le pré-ARN messager figuré par le trait noir (ARN simple brin). Ce pré-ARN messager est épissé (élimination des autres segments non fonctionnels et des introns et jonction entre l'exon pour générer l'ARN messager codant pour le récepteur des cellules B. A noter la région poly A en position terminale. Cet ARN est traduit en protéine BCR chaîne lourde.
Partie droite: chaîne légère des récepteurs des cellules B. Le locus génétique du récepteur des cellules B situé sur le chromosome 2, est figuré par un double axe noir (ADN en double brin). Il est constitué de 50 segments V (exons codant pour la région variable, rectangles rouges), 5 segments J (régions de jonction, rectangles bleus) et 1 segment C (région constante, rectangle marron) séparés par des introns (Cinelli 2018). Dans le schéma montré ici, la recombinaison D-J-C se fait sur les segments V2, J1 et C. Les exons et introns situés entre V2, J1 et C sont éliminés. L'ARN polymérase ADN-dépendante génère le pré-ARN messager figuré par le trait noir (ARN simple brin). Ce pré-ARN messager est épissé pour générer l'ARN messager codant pour le récepteur des cellules B légères.
Partie basse. Selon les segments V, D et J aléatoirement sélectionnés et assemblés, les protéines BCR lourde et BCR légère seront différentes. Ce processus de recombinaison génétique se produit dans les cellules B en maturation dans dans la moelle osseuse. En tenant compte du nombre des segments V, D et J différents recombinés dans les locus récepteur des celulles B, le nombre de régions variables différentes sur le récepteur dimérique (c'est à dire liant spécifiquement un antigène) est de l'ordre de 4,6x106 (Mattia Cinelli, Thèse, University College of London, 2020).
A côté des recombinaisons génétiques somatiques décrites ci-dessus, deux processus interdépendants diversité jonctionnelle (voir plus haut au sujet des lymphocytes T) et hyper mutations somatiques se produisent dans les centres germinatifs des organes lymphoïdes secondaires (sites dans lesquels les lymphocytes B prolifèrent et se différencient), participent à l'augmentation de la diversité dans les régions variables des anticorps.
Hyper mutations somatiques
Ces mutations ont lieu dans les organes lymphoïdes secondaires (rate et ganglions lymphatiques) après que le lymphocyte B ait rencontré son antigène. Elles affectent les séquences codant les région variables de liaison à l'antigène des gènes d'immunoglobuline (chaînes lourde et légère) avec un taux jusqu'à 1 000 000 fois supérieur à celui des recombinaisons VDJ qui se produisent dans les lignées cellulaires de la moëlle osseuse. Bien que le mécanisme exact de ces hyper mutations ne soit toujours pas connu, il semble que la cytidine désaminase induite lors de l'activation des cellules B y joue un rôle central. On estime que 1 à 2 mutations se produit(sent) par région variable et par génération de cellules. En modifiant la spécificité et l'affinités de liaison des anticorps pour leur antigène, ces hyper mutations permettent une efficacité optimale de l'interaction anticorps-antigène (plusieurs milliers de milliards de possibilités). (Bello et al. Cell Cycle 2023 ; Maramatsu et al. Cell 2000).
Sélection clonale
Les cellules B qui ont subi les hyper mutations somatiques se retrouvent en compétition avec leurs congénères pour se développer. En effet, les ressources énergétiques, la disponibilité des cellules Th et les autres éléments cellulaires dépensés durant la croissance des cellules B sont limitées. Les cellules dendritiques au sein des follicules des centres germinaux présentent l'antigène aux cellules B. Et ce sont les cellules B qui auront acquis l'affinité la plus élevée pour l'antigène qui seront sélectionnées pour survivre. Sur plusieurs cycles de sélection, les cellules B sécrètent des anticorps possédant une affinité optimale pour l'antigène.
Cet ensemble de mécanismes permet au système immunitaire d'adapter sa réponse aux nouvelles menaces au cours de la vie d'un organisme. Cependant, les hyper mutations somatiques mal ciblées représentent un mécanisme probable dans le développement des lymphomes et de nombreux autres cancers. (Victoria, Annu Rev Immunol 2022).
Activation des lymphocytes B
Les lymphocytes B dits "matures naïfs", matures du fait de l'acquisition de leur récepteur et naïfs car n'ayant pas encore rencontré d'antigène, quittent la moelle osseuse pour migrer via le sang et la lymphe vers les organes lymphoïdes secondaires : ganglions lymphatiques, rate, amygdales, appendice et membranes muqueuses. C'est dans ces organes lymphoïdes que se trouvent les cellules dendritiques et les macrophages chargés de présenter les antigènes issus de la phagocytose des agents pathogènes fixés sur les protéines du CMH-I et du CMH-II. Quand un lymphocyte B est activé lors de sa première rencontre avec un antigène qui se fixe sur les récepteurs présents sur sa surface, la cellule prolifère et se différencie pour générer d'une part, une population de plasmocytes, cellules B qui vont générer les anticorps, et d'autre part, des cellules mémoires B qui pourront être rapidement mobilisées lors d'une infection future.
L'activation des cellules B se fait suivant deux processus différents selon la manière dont elles rencontrent l'antigène : une activation indépendante des lymphocytes T, et une activation dépendante des lymphocytes T.
Activation indépendante des lymphocytes T
Ce processus d'activation se fait en 2 étapes au contact des antigènes tels que ceux portés par des polymères possédant des épitopes répétitifs, comme les polysaccharides, les glycolipides et les acides nucléiques. Dans la première étape, la fixation du récepteur des lymphocytes B sur ces polymères entraîne la formation de clusters du récepteur. La formation de ces clusters permet l'activation de l'hétérodimère Iga-Igb dont la fonction est de transmettre le signal vers le noyau de la cellule. Dans la deuxième étape de cette activation, les récepteurs de reconnaissance de motif moléculaire dont nous avons parlé plus haut se lient aux motifs correspondants présents sur l'agent pathogène. Les cellules B se différencient alors en plasmocytes qui se divisent et produisent essentiellement des anticorps IgM. Les cellules B mémoires ne sont pas produites, ou produites en très faible quantité par ce processus d’activation.
Activation dépendante des lymphocytes T
Les antigènes qui activent les cellules B par l’intermédiaire des cellules T sont connus sous le nom d'antigènes dépendants des cellules T sont issus de protéines étrangères. Ils sont appelés ainsi parce qu'ils sont incapables d'induire une réponse humorale dans les organismes dépourvus de cellules T. Les réponses des cellules B à ces antigènes prennent plusieurs jours, bien que les anticorps générés aient une affinité plus élevée et soient plus polyvalents sur le plan fonctionnel que ceux générés par l'activation indépendante des cellules T (voir paragraphe précédent). (Blum et al. Annu Rev Immunol 2013; Crotty, Nature Rev Immunol 2015)
Une fois qu'un BCR se lie à un antigène dépendant des cellules T, l'antigène est absorbé dans la cellule B par endocytose médiée par le récepteur, dégradé et présenté aux cellules T sous forme de fragments de peptides complexés avec les molécules du CMH-II sur la membrane cellulaire. Les cellules T auxiliaires (Th), généralement les cellules T auxiliaires folliculaires (Tfh, voir Figure 10), reconnaissent et lient ces complexes CMH-II-peptides par l'intermédiaire de leur récepteur de cellules T (TCR). Après la liaison TCR-MHC-II-peptide, les cellules B sont activées. Le co-récepteur CD40 des lymphocytes B et les cytokines produites par le Th participent à ce processus d’activation.
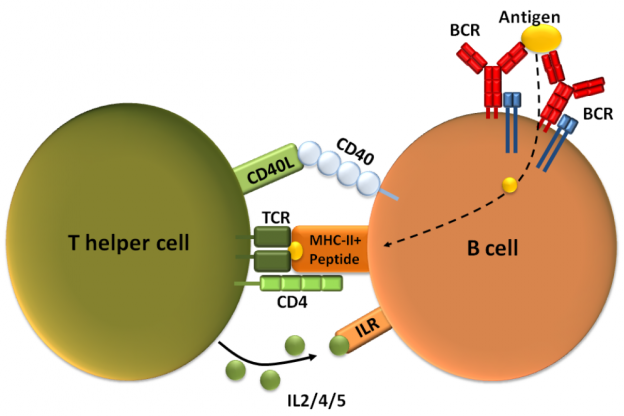
Figure 13. Activation dépendante des lymphocytes T
A gauche la cellule Th (Tfh, voir figure 10) qui exprime le TCR (récepteur de cellules T), diverses cytokines, IL-2, -4, -5 et autres, et diverses protéines membranaires (CD40L et CD4). A droite la cellule B qui exprime le BCR (Récepteur des cellules B ayant lié l'antigène en jaune). Cette cellule présente l'antigène (cercle jaune) au TCR par l'intermédiaire du CMH-II. Elle possède par ailleurs les récepteurs des cytokines (ILR) et la protéine CD40 qui selie à CD40L. (Source, Janeway).
Une fois activés, les lymphocytes B peuvent suivre deux étapes distinctes de différenciation.
La première étape produit à la fois des plasmablastes (précurseurs des plasmocytes) à courte durée de vie pour une protection immédiate et des plasmocytes (cellules B pleinement différenciées productrices d’anticorps) à longue durée de vie et des lymphocytes B mémoires pour une protection persistante (Nutt et al. Nature Rev Immunol 2015). Cette étape, se produit en dehors des ganglions lymphatiques mais toujours dans les organes lymphoïdes secondaires. Au cours de cette étape, les lymphocytes B activés prolifèrent, peuvent subir un changement de classe d'immunoglobulines et un processus d’hypermutation somatique faible ; ils se différencient en plasmablastes qui produisent des anticorps précoces et peu actifs, principalement de classe IgM.
La deuxième étape consiste en un retour des cellules B activées dans un ganglion lymphatique et la formation d'un centre germinal, qui est un microenvironnement spécialisé où les cellules B subissent une prolifération importante, un changement de classe d'immunoglobuline et une maturation d'affinité par hypermutation somatique (Shlomchik & Weizel, Immunol Rev 2012). Ces processus sont facilités par les cellules Tfh (voir figure 10) dans le centre germinal et génèrent à la fois des lymphocytes B mémoire à haute affinité et des plasmocytes à longue durée de vie. Les plasmocytes résultants sécrètent de grandes quantités d'anticorps et restent dans les organes lymphoïdes secondaires ou, plus préférentiellement, migrent vers la moelle osseuse.
Le changement de classe des immunoglobulines
La commutation d'isotype ou de classe est un processus biologique qui se produit après l'activation du lymphocyte B et qui permet à la cellule de produire différentes classes d'anticorps (IgA, IgE ou IgG). Les différentes classes d'anticorps, et donc les fonctions effectrices, sont définies par les régions constantes (C) de la chaîne lourde de l'immunoglobuline. Au départ, les cellules B naïves n'expriment que des IgM et IgD de surface cellulaire avec des régions de liaison à l'antigène identiques (voir la figure 11). Chaque isotype est adapté à une fonction distincte ; par conséquent, après activation, un anticorps ayant une fonction effectrice IgG, IgA ou IgE peut être nécessaire pour éliminer efficacement un antigène. La commutation de classe permet à différentes cellules filles issues d'un même lymphocyte B activé de produire des anticorps d'isotypes différents. Seule la région constante de la chaîne lourde de l'anticorps change pendant la commutation de classe ; les régions variables, et donc la spécificité de l'antigène, restent inchangées. Ainsi, la descendance d'une seule cellule B peut produire des anticorps, tous spécifiques du même antigène, mais avec la capacité de produire la fonction effectrice appropriée à chaque défi antigénique. Le changement de classe est déclenché par les cytokines ; l'isotype généré dépend des cytokines présentes dans l'environnement des cellules B (Stavnezer et al. Annu Rev Immunol 2008).
Troisième phase : la phase de mémoire immunitaire
Cette phase très importante permet à l'organisme de garder quelques-uns des spécialistes (cellules T et cellules B) sous la main. Si le même virus attaque à nouveau, ces "cellules mémoire B et T" peuvent entrer en action et lancer la branche adaptative du système immunitaire sans les délais de plusieurs jours nécessaires à la mise en place de la phase adaptative. La mémoire est la base de l'immunité telle que nous la connaissons familièrement - une défense durable contre tout ce qui a précédemment affligé l'organisme (Bortnik et al. J Immunol 2012; McHeyzer-Williams et al. Nature Rev Immunol 2011).
Les anticorps
Les anticorps sont de grandes protéines en forme de Y appartenant à la superfamille des immunoglobulines qui sont utilisées par le système immunitaire pour identifier et neutraliser les pathogènes étrangers tels que les bactéries et les virus.
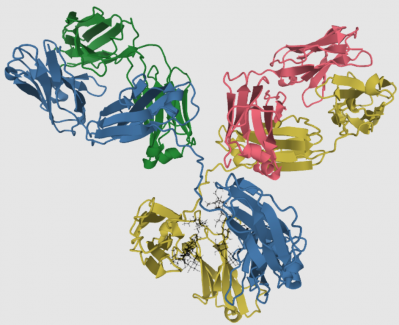
Figure 14. Structure d’un anticorps.
La structure d'un anticorps monoclonal intact contre le phénobarbital, sous-classe IgG1, a été déterminée à une résolution de 3,2 A par cristallographie aux rayons X. Cette structure apparaît ici sous la forme d’un ruban figurant l’enchaînement des acides aminés qui constituent la protéine. Les deux chaines légères sont montrées en vert et fuschia. Les deux chaines lourdes sont en bleu et jaune. On reconnait la structure en Y, la partie basse sur le schéma figurant la partie constante de l’anticorps, la partie haute du schéma figurant les parties variables, les 2 branches du Y, qui vont lier l’antigène (Source : Berman et al. The Protein Data Bank Nucleic Acids Research, 2020).
Un anticorps est la forme sécrétée du récepteur des cellules B. Chaque anticorps reconnaît un ou plusieurs antigènes spécifiques (Litman et al. Molecular Biology and Evolution 1993). Chacune des 2 pointes du "Y" d'un anticorps contient un paratope qui se lie spécifiquement à un épitope particulier d'un antigène. Grâce à ce mécanisme, les anticorps peuvent : i) efficacement reconnaître un pathogène ou une cellule infectée pour qu'ils soient attaqués par d'autres parties du système immunitaire, ou ii) neutraliser directement le pathogène par exemple, en bloquant la protéine d'un virus qui est essentielle à son invasion (cas de la protéine S du SARS-CoV-2).
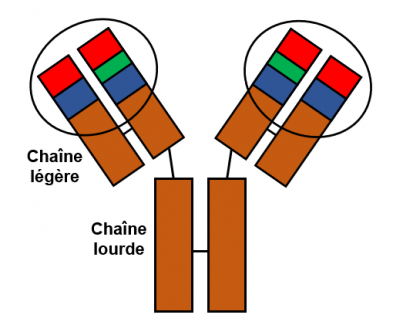
Figure 15. Schéma d’un anticorps circulant.
Cette figure schématise la précédente (Figure 14).

Table 2. Différentes classes des anticorps et leurs fonctions
Chez l'homme, les anticorps se répartissent en cinq classes, aussi appelées isotypes : IgA, IgD, IgE, IgG et IgM (Table 2 ci-dessus). Les anticorps humains IgG et IgA sont également divisés en sous-classes distinctes (IgG1, IgG2, IgG3, IgG4 ; IgA1 et IgA2), (Woof & Burton, Nature Rev Immunol 2004). La classe fait référence aux fonctions effectrices de l'anticorps, en plus de certaines autres caractéristiques structurelles. Les anticorps de différentes classes diffèrent également par l'endroit où ils sont libérés dans l'organisme et par le stade de la réponse immunitaire (voir la table ci-dessus). Le terme d'immunité humorale est souvent considéré comme synonyme de la réponse anticorps, décrivant la fonction du système immunitaire qui existe dans les humeurs (fluides) du corps sous forme de protéines solubles, par opposition à l'immunité à médiation cellulaire, qui décrit généralement les réponses des cellules T (en particulier les cellules T cytotoxiques).
En général, les anticorps sont considérés comme faisant partie du système immunitaire adaptatif, bien que cette classification puisse devenir compliquée pour certains d’entre eux. Par exemple, les IgM naturelles (Ehrenstein & Notley, Nat Rev Immunol 10), fabriquées par les cellules de la lignée B-1 sont des anticorps IgM produits indépendamment d'une réponse immunitaire et présentent une poly réactivité, c'est-à-dire qu'ils reconnaissent plusieurs antigènes distincts (non apparentés). Ils peuvent collaborer avec le système du complément dans les premières phases d'une réponse immunitaire pour faciliter l'élimination de l'antigène incriminé et l'acheminement des complexes immunitaires résultants vers les ganglions lymphatiques ou la rate en vue de l'initiation d'une réponse immunitaire. À ce titre, la fonction de ces anticorps est donc plus proche de celle de l'immunité innée que de celle de l'immunité adaptative. Néanmoins, les anticorps sont généralement considérés comme faisant partie du système immunitaire adaptatif parce qu'ils font preuve d'une spécificité exceptionnelle (à quelques exceptions près), qu'ils sont produits par des réarrangements génétiques (plutôt que d'être codés directement dans la lignée germinale) et qu'ils sont une manifestation de la mémoire immunologique.
Date de dernière mise à jour : 28/11/2025
Ajouter un commentaire
