Les candidats vaccins français
Institut Pasteur
MV-SARS-CoV-2
L’Institut Pasteur développe un vaccin anti-SARS-CoV-2 appelé MV-SARS-CoV-2. Il s’agit d’un vaccin utilisant la stratégie du vecteur viral en l’occurrence ici le virus de la rougeole (Measles Virus).
Le vaccin contre la rougeole est largement utilisé depuis plus de 40 ans, distribué dans le monde entier, et a déjà été administré à plus de 2 milliards d’enfants avec succès. Il confère une protection de 95% sans effet secondaire notable. En utilisant le virus de la rougeole comme vecteur pour construire de nouveaux vaccins contre d’autres pathogènes, on espère obtenir ces mêmes caractéristiques.
Dans cette approche, développée depuis plusieurs années par les chercheurs de l’Institut Pasteur, le virus de la rougeole (vivant, atténué et non pathogène) est utilisé comme vecteur d’antigène, une sorte de cheval de Troie. Cette stratégie est décrite sur ce site ICI. Pour élaborer ce vaccin, la séquence d’ARN codant pour la protéine S du SARS-CoV-2 a été intégrée dans le génome du virus de la rougeole. Lorsque le virus pénètre dans une cellule, il délivre son génome et la machinerie cellulaire synthétise les protéines codées par ce génome, et notamment la protéine S du SARS-CoV-2. Cette protéine est tout de suite reconnue par la cellule comme étant « étrangère » et elle est digérée en petits fragments (peptides) qui sont présentés à la surface de la cellule par le complexe majeur d’histocompatibilité et la réponse immunitaire se met en place (production d’anticorps et de lymphocytes cytotoxiques).
Un essai clinique de phase 1 a démarré en Septembre 2020 dans le cadre d’un consortium entre Institut Pasteur de Paris et l’autrichien Themis Bioscience GmbH (Themis), récemment absorbé par l’américain Merck Sharp et Dohme (Juin 2020), et l’Université de Pittsburgh/Center for Vaccine Research (CVR). Premiers résultats de la phase 1/2 attendus fin 2020.
Le développement de ce candidat vaccin a été abandonné, les premiers résultats ne montrant pas une efficacité suffisante.
Sanofi Pasteur
Sanofi Pasteur est la « Division Vaccins » du groupe Sanofi depuis 2004. Cette division développe deux candidats vaccins, un vaccin à ARN appelé MRT5500 et un vaccin basé sur la protéine S (Spike) recombinante du SARS-CoV-2.
MRT5500
Parmi les diverses plates-formes vaccinales innovantes en cours de développement dans l'industrie des vaccins, les vaccins à ARN sont considérés comme les plus prometteurs. Voir sur ce site ICI. Sanofi Pasteur développe un vaccin à ARN messager MRT5500, en partenariat avec la compagnie américaine Translate Bio. La séquence de l’ARN viral qui constitue le vaccin est basée sur la souche SARS-CoV-2 280 Wuhan Hu-1 strain (Genbank accession MN908947) mais elle a été modifiée par deux mutations de façon à coder pour une protéine S pré-fusionnelle dont la conformation est stabilisée (meilleur antigène). Cet ARN est formulé dans des nanoparticules lipidiques constituées de lipides cationiques (chargés positivement). Le vaccin est administré par voie intramusculaire en deux doses séparées par un intervalle de 3 semaines. L’évaluation pré-clinique du MRT5500 (Kalnin et al. BioRxiv 2020) a été conduite chez la souris et le macaque Cynomolongus après deux administrations du vaccin. Les résultats montrent un profil de réponse immunitaire humorale et cellulaire très satisfaisant contre le SARS-CoV-2, avec notamment chez le macaque, une induction de niveaux élevés d'anticorps neutralisants, comparables à la plage supérieure de ceux observés chez les humains infectés, et une réponse cellulaire de type TH1 (IFN-g).
Ces données justifient la poursuite du développement clinique de ce candidat vaccin et la conduite d’un essai clinique de phase 1/2 en cours (Novembre-Décembre 2020). Sanofi prévoit une approbation par les autorités de santé au second semestre 2021. Translate Bio a établi une capacité de fabrication d'ARN et Sanofi planifie la production annuelle de 90 à 360 millions de doses.
Protéine S recombinante
Pour le développement de ce vaccin, Sanofi Pasteur a créé un partenariat avec le britannique GSK (Glaxo-Smith-Kline) et utilise sa plateforme d'ADN recombinant par baculovirus pour produire la protéine S (Skipe) du SARS- CoV-2. La technologie d’ADN recombinant consiste à synthétiser au laboratoire un ADN spécifique d’un gène qui va coder pour une protéine spécifique dite « recombinante ». Le baculovirus est un virus qui infecte spécifiquement et exclusivement des cellules d'insectes. Dans le cas présent, l’ARN viral codant pour la protéine S a été rétro-transcrit en ADN et cet ADN a été introduit dans le génome du baculovirus. Le baculovirus sert alors de vecteur pour infecter des cellules d'insecte qui produiront la protéine S dite « recombinante ». De plus, cette étape permet de modifier ponctuellement la séquence de la protéine produite, par exemple, permettre son expression sous une forme plus stable qui assurera une bonne immunogénicité et permettra ainsi d’obtenir de meilleur titres d’anticorps pouvant neutraliser le virus en cas d’infection du patient.
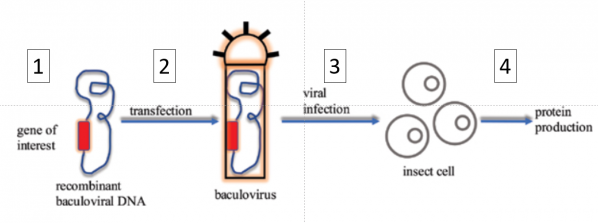
Figure : Production de protéines recombinantes par le système du baculovirus
Schéma très simplifié de la procédure. 1. L’ADN recombinant codant pour la protéine S du SARS-CoV-2 (rouge) a été introduit dans le génome du baculovirus (bleu). 2. Ce génome est transfecté dans des cellules d’insecte qui produisent de larges quantités de baculovirus. 3. Le baculovirus produit est purifié et utilisé pour infecter des cellules d’insecte en culture. 4. La culture de ces cellules permet la production de grandes quantités de la protéine S recombinante (Mishra et al. Protein & Peptide Letters 2020).
Pourquoi cette technologie d'expression par baculovirus ? Parce qu’elle permet la production rapide de grandes quantités de la protéine en question. La protéine S recombinante sera formulée avec un adjuvant produit par GSK pour stimuler le système immunitaire. GSK a développé ces dernières années des adjuvants performants dont le but est d’activer spécifiquement la réponse immunitaire innée, permettant la mise en place de la réponse immunitaire adaptative avec production d’anticorps et de lymphocytes cytotoxiques. Lors des études pré-cliniques, ce vaccin était immunogène et offrait une protection partielle dans les modèles animaux.
Ce travail de développement grâce au rachat par Sanofi en 2017 de la société Protein Sciences devrait permettre la production rapide de grandes quantités du vaccin candidat pour les essais cliniques. Sanofi attend les premiers résultats de la phase 1/2 en Décembre prochain, avec un lancement de la phase 3 dans la foulée. Sanofi prévoit une approbation par les autorités de santé au second semestre 2021.
Le développement de ce candidat vaccin a été retardé par la mise en place de nouvelles études, les premiers résultats ne montrant pas une efficacité suffisante. Si tout va bien, l'entrée en phase 3 devrait se faire dans le deuxième semestre de 2021.
Date de dernière mise à jour : 03/02/2021
Ajouter un commentaire