CRISPR et embryons humains
Edition génomique germinale :
Des embryons humains modifiés par CRISPR/Cas9
Mon but dans la rédaction de cette nouvelle n’est pas de prendre position pour ou contre l’édition génomique germinale étant donnée son impact au plan de la bioéthique, mais simplement de la décrire.
Le contexte
Il existe plus de 10 000 maladies génétiques héréditaires dues à une ou plusieurs mutations dans un ou plusieurs gènes et on estime à plusieurs centaines de millions le nombre de personnes qui en sont atteintes sur la planète. Parmi ces maladies, certaines se transmettent sur le mode autosomique dominant (c’est à dire qu’un seul allèle muté suffit à produire la maladie) et leur mise en place est suffisamment tardive pour qu’elles soient transmissibles à la descendance. Dans de tels cas (voir par exemple sur ce site la maladie de Huntington) 50% des enfants du couple sont touchés.
Un moyen de prévenir ces maladies est le diagnostic préimplantatoire (DPI), c’est à dire la recherche de la mutation sur les embryons générés par fécondation in vitro (FIV), suivie de la sélection d'embryons non porteurs qui pourront être implantés dans l'utérus de la mère. Mais le seul espoir d’éradication définitive de telles maladies est la thérapie génique, c’est à dire la correction de la ou des mutations responsables de la pathologie. Et c'est ici que la méthodologie CRISPR/Cas9 prend toute son importance (voir le dossier CRISPR/Cas sur ce site). La thérapie génique via CRISPR/Cas9 peut être entreprise soit au niveau des cellules de l’individu lorsque la maladie est déjà déclarée (et il faut donc être capable de traiter un maximum sinon l’entièreté des cellules de l’organisme, du tissu ou de l'organe dans lequel la maladie s'exprime), soit au niveau même des gamètes ou du zygote qui vont donner l’embryon. Il s’agit alors d’une édition génétique germinale. C'est l'objet de cette nouvelle.
La méthodologie CRISPR/Cas9 appliquée à la correction de mutations génétiques doit satisfaire à plusieurs critères
- La réparation du génome muté doit résulter de la recombinaison homologue, et non de la jonction d’extrémités non homologues cette dernière étant responsable d’insertions ou de délétions non voulues sur le site de la mutation (voir ce site CRISPR/Cas édition génomique, Figures 9 et 10).
- Dans le cas d’une édition génomique germinale, le mosaïcisme de l’embryon est inacceptable.
Mosaïcisme : c’est l’état d’un embryon (ou d’un organisme) constitué de plusieurs populations de blastomères (ou de cellules) de génotype différent.
- Enfin, il faut éviter absolument les effets “hors-cible” (off-target en anglais), c’est à dire éviter que CRISPR/Cas9 touche un autre locus génétique dans le génome qui aurait une séquence d’ADN voisine (homologue) de la séquence visée. Si une telle éventualité se présentait, cette séquence serait indûment reconnue par l'ARN guide et coupée par Cas9, générant ainsi une mutation à ce locus.
Après les publications de trois équipes Chinoises sur ce sujet (Liang et al.2015 ; Kang et al. 2016 ; et Tang et al. 2017), c’est au tour d’une équipe multinationale (Etats Unis, Corée du Sud, Chine) dirigée par Sukrat Mitalipov de présenter ses résultats début Août 2017 (Ma et al. Correction of a pathogenic gene mutation in human embryos. Nature 2017).
L’étude de Mitalopov
 Ce travail dont l’objet était de modifier le génome de gamètes (ovocytes) et d’embryons humains a été réalisé avec l’autorisation et sous le contrôle des autorités de santé de l’Université de l’Oregon (Oregon Health & Science University (OHSU) et du conseil de surveillance de recherche sur les cellules souches de l’Oregon (OSCRO) qui en avaient préalablement évalué l’intérêt au plan scientifique et médical.
Ce travail dont l’objet était de modifier le génome de gamètes (ovocytes) et d’embryons humains a été réalisé avec l’autorisation et sous le contrôle des autorités de santé de l’Université de l’Oregon (Oregon Health & Science University (OHSU) et du conseil de surveillance de recherche sur les cellules souches de l’Oregon (OSCRO) qui en avaient préalablement évalué l’intérêt au plan scientifique et médical.
Le comité d’éthique ad hoc de l’université était composé de 11 membres : un laïque, un médecin obstétricien gynécologue, trois bioéthiciens, un membre du comité d’éthique de l’OHSU, trois membres de l’OSCRO, un clinicien généticien et un clinicien. Après examen du projet de recherche, ce comité avait donné son accord dans le cadre d’un contrôle, d’un dialogue continu et d’une surveillance très stricts des études à réaliser, à savoir, l’optimisation de la technologie CRISPR/Cas9 sur des embryons humains dans le but d’évaluer au plan strictement fondamental l’édition génomique germinale avant toute utilisation en clinique.
Les personnes donneuses de gamètes avaient signé un accord de consentement éclairé sur la nature des recherches qui seraient effectuées avec leurs gamètes, et notamment les modifications génétiques sur les embryons générés pour cette étude.
Rappellons qu'aux Etats Unis, les fonds fédéraux ne peuvent être utilisés pour la recherche sur les embryons humains. Sukrat Mitalipov (photo) a donc dû trouver ses financements ailleurs (fonds institutionnels privés aux USA pour les équipes Américaines et fonds institutionnels et publics en Corée du Sud et en Chine pour les équipes correspondantes) pour mener à bien cette étude au cours de laquelle environ 120 embryons humains ont été générés, analysés puis détruits.
Dans une première série d’expériences,
des ovocytes de donneuses “normales” (non porteuses de mutation, wild-type, WT, en anglais) ont été fécondés par le sperme d’un donneur porteur hétérozygote de la mutation MYBPC3GAGT (délétion de 4 nucléotides G, A, G, T dans l’exon 16 du gène MYBPC3), ou d’un donneur “normal” (non porteur de la mutation).
Cette mutation du gène MYBPC3 produit une cardiomyopathie hypertrophique entraînant des perturbations des fonctions électriques du cœur et souvent responsables de mort subite notamment chez des jeunes sportifs. Du fait de sa mise en place relativement tardive dans la vie de l’individu porteur, cette mutation échappe à la sélection naturelle et est transmise à la descendance.
Les zygotes produits étaient comme attendu pour moitié normaux (47,4%) et pour moitié (52,6%) mutés au niveau du gène MYBPC3.
Dix huit heures après fertilisation (phase S de synthèse de l’ADN), les zygotes ont subit une micro-injection directe dans leur cytoplasme de la protéine Cas9, de deux ARN guides spécifiquement créés pour produire une cassure double brin de part et d'autre de la mutation MYBPC3GAGT sur l’allèle paternel, et pour certains d’entre eux d’un ADN de réparation exogène (voir ce site CRISPR/Cas édition génomique, Figure 9). Trois jours plus tard, les 54 embryons générés étaient détruits et le génotype des blastomères était analysé.
Blastomère : premières cellules toutes identiques constituant l’embryon. Par exemple au stade morula, l’embryon compte 16 blastomères.
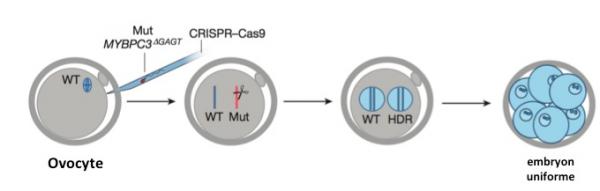
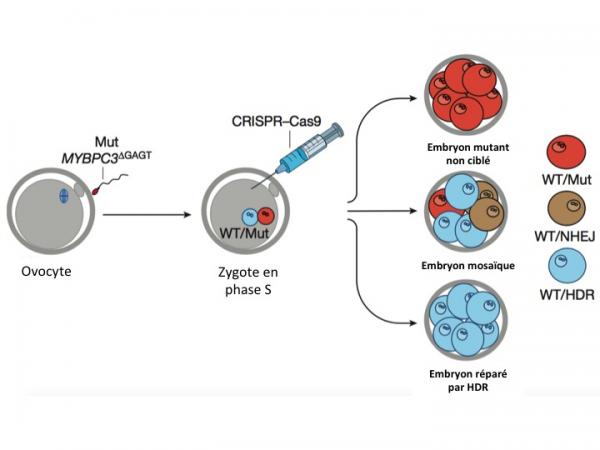 Figure 1, adaptée de l'article de Mitalipov. Correction génétique par CRISPR/Cas9 d'embryons humains en phase S (synthèse d'ADN). WT (wild type, normal) caractérise l'allèle maternel normal de MYBPC3; Mut caractérise l'allèle paternel muté (MYBPC3GAGT); NHEJ se réfère à la jonction d'extrémités non homologues; HDR se réfère à la recombinaison homologue. Partie droite de la figure: les blastomères rouges sont hétérozygotes pour le locus MYBPC3: MYBPC3 normal (WT)/MYBPC3GAGT. Les blastomères bleus sont homozygotes pour le locus MYBPC3 normal et certains d'entre eux (17% voir plus loin) ont été réparés par recombinaison homologue. Les blastomères marrons sont hétérozygotes pour le locus MYBPC3 : MYBPC3 normal/MYBPC3 indel. L'embryon central présente un mosaïcisme car il est formé de blastomères de génotype différent (3 espèces).
Figure 1, adaptée de l'article de Mitalipov. Correction génétique par CRISPR/Cas9 d'embryons humains en phase S (synthèse d'ADN). WT (wild type, normal) caractérise l'allèle maternel normal de MYBPC3; Mut caractérise l'allèle paternel muté (MYBPC3GAGT); NHEJ se réfère à la jonction d'extrémités non homologues; HDR se réfère à la recombinaison homologue. Partie droite de la figure: les blastomères rouges sont hétérozygotes pour le locus MYBPC3: MYBPC3 normal (WT)/MYBPC3GAGT. Les blastomères bleus sont homozygotes pour le locus MYBPC3 normal et certains d'entre eux (17% voir plus loin) ont été réparés par recombinaison homologue. Les blastomères marrons sont hétérozygotes pour le locus MYBPC3 : MYBPC3 normal/MYBPC3 indel. L'embryon central présente un mosaïcisme car il est formé de blastomères de génotype différent (3 espèces).
Les résultats ont été les suivants :
- 67% (36/54) des embryons étaient homogènes (tous les blastomères présentant le même génotype) et homozygotes pour l’allèle normal MYBPC3 (WT). Ceci traduit un rendement de 17% au dessus du nombre attendu d’embryons homozygotes pour l’allèle MYBPC3 normal non traités par CRISPR/Cas9 (qui serait de 50%).
- 9% (5/54) des embryons étaient homogènes et hétérozygotes pour la mutation (non corrigés par CRISPR/Cas9).
- 24% (13/54) des embryons présentaient un état de mosaïcisme, c’est à dire qu’ils étaient constitués de plusieurs populations de blastomères de génotype différent : 52% étaient homozygotes pour l’allèle normal (corrigés), 18% étaient hétérozygotes pour la mutation (non corrigés) et 30% étaient hétérozygotes pour des mutation MYBPC3indel, c’est à dire dans lesquels la mutation avait été corrigée par jonction d’extrémités non homologues avec pour conséquence des mutations par insertion ou délétion (inacceptable au plan clinique et médical).
- Au final, 72% des embryons ont été ciblés par le traitement CRISPR/Cas9 et pour 64% d’entre eux la mutation sur l’allèle muté a été corrigée.
Comme le pourcentage de blastomères homozygotes pour l’allèle normal ne dépendait pas du traitement avec l’ADN de réparation, les auteurs concluaient que la réparation s’était faite par recombinaison "inter-homologue", l’allèle normal maternel ayant joué le rôle d’ADN de réparation.
C’est le point majeur de cet article.
En revanche, le problème soulevé ici est celui du mosaïcisme.
Le mosaïcisme est un élément inacceptable au plan des applications cliniques et médicales de cette technologie.
C’est pour tenter de résoudre ce problème du mosaïcisme qu’une deuxième série d’expériences a été entreprise.
Ici, ce ne sont plus les zygotes mais les gamètes (ovocytes) qui ont subit une micro-injection intra cytoplasmique du sperme du donneur (porteur de la mutation MYBPC3GAGT) et du système CRISPR/Cas9/ADN de réparation. Trois jours plus tard, les 58 embryons générés étaient détruits et le génotype des blastomères analysé.
Figure 2, adaptée de l'article de Mitalipov. Correction génétique par CRISPR/Cas9 d'ovocytes humains. Même légende qu'en Figure 1.
Les résultats ont été les suivants :
- aucun signe de mosaïcisme n’était détecté (à l’exception d’un seul embryon qui contenait des cellules à deux allèles normaux, et des cellules hétérozygotes contenant l’allèle normal et l’allèle réparé par l’ADN de réparation).
- 72% (42/58) des embryons étaient homogènes et homozygotes pour l’allèle MYBPC3 normal (WT). Ceci traduit un rendement de 22% au dessus du nombre attendu d’embryons homozygotes pour l’allèle MYBPC3 normal (qui est de 50%). Ici encore, le pourcentage de blastomères homozygotes pour l’allèle normal ne dépendait pas du traitement avec l’ADN de réparation.
- 28% (16/58) des embryons étaient homogènes et hétérozygotes pour l’allèle muté après réparation par jonction d'extrémités non homologues (MYBPC3indel) non représentés sur la figure ci-dessus.
En conclusion
Les résultats de l'étude conduite par Mitalipov montrent que:
- Le rendement de réparation est supérieur lorsque le traitement CRISPR/Cas9 est effectué sur les ovocytes (22%) par rapport à ce qui est observé après traitement effectué sur les embryons en phase S (17%).
- Les cassures double brin générées par Cas9 dans le génome du zygote et de l’ovocyte humains sont réparées par recombinaison inter-homologue avec l’allèle normal, c’est à dire l’allèle maternel utilisé comme matrice de réparation.
- Ce mode de réparation est aussi fréquent sinon plus fréquent que le mode de réparation par jonction des extrémités non homologues (génératrice de mutations).
- Le fait que l’allèle muté puisse être efficacement réparé sans apparition de mosaïcisme est un élément important pour le futur de cette méthode dans le traitement des maladies génétiques monogéniques.
- Aucun effet "hors-cible" lors de la réparation de l’allèle muté de MYBPC3 n'a été détecté par séquençage extensif du génome et de l’exome des blastomères.
Nul doute que ce travail, beaucoup plus extensif que les trois études Chinoises précédentes, appelle un grand nombre de commentaires et de critiques.
A suivre donc...
Voir aussi sur ce site et sur le même sujet:
Date de dernière mise à jour : 04/12/2018
Ajouter un commentaire