Le variant Omicron
Pourquoi le variant Omicron serait-il plus contagieux et moins dangereux que ses prédécesseurs ?
Résumé tout public
Les premières indications en provenance d'Afrique du Sud, du Royaume-Uni et d'autres pays dont les Etats Unis et l'Europe suggèrent que le variant Omicron du coronavirus SARS-CoV-2 se propage plus rapidement mais est moins dangereux que son prédécesseur Delta et les autres variants. Une série d'études expérimentales décrites ci-dessous expliquent ces différences : le variant Omicron présenterait un mécanisme d'entrée dans les cellules différent de celui des autres variants et infecterait préférentiellement les cellules des voies respiratoires supérieures (épithélium nasal) au dépend de celles des voies pulmonaires basses (pneumocytes des alvéoles) dont l'infection peut conduire à une COVID grave ou fatale par suractivation du système immunitaire.
Omicron est le cinquième variant "préoccupant" et se caractérise par un changement radical de sa capacité de transmission, ce qui suggère des changements antigénique et biologique importants. Il présente 45 substitutions d'acides aminés, dont 30 dans la protéine S (Spike) par rapport au variant "original" Wuhan-2019. Quinze de ces substitutions se trouvent dans le domaine de liaison au récepteur, une zone fortement associée à l'évasion immunitaire humorale (Voir sur cette page "Le variant Omicron", l'article suivant).
Les autorités sud-africaines annonçaient le 30 décembre que le pays avait passé son pic d'infection par le variant Omicron sans connaître un pic majeur de décès. Le 31 décembre, un rapport du gouvernement britannique indiquait qu'en Angleterre, les personnes infectées par le variant Omicron étaient deux fois moins susceptibles de devoir être hospitalisées ou de recevoir des soins d'urgence que celles infectées par le variant Delta, avec une même tendance selon les données en Ecosse (The University of Edinburgh). Au 12 janvier 2022, en France et dans les autres pays Européens (Italie, Espagne, Allemagne), bien que le nombre de cas explose, le nombre des décès dus à la COVID-19 ne montre pas la même explosion et reste voisin de celui qui prévalait durant la quatrième vague. Ces données peuvent être vérifiées sur le site du Center for Systems Science and Engineering, Johns Hopkins University.
Cependant, du fait que les personnes qui ont acquis une protection immunitaire contre le SARS-CoV-2 via la vaccination ou l'infection ou les deux puissent à nouveau être infectées (mais non obligatoirement malades), la question de savoir si Omicron provoque une COVID-19 plus ou moins bénigne que les variants précédents se pose nécessairement.
Pour répondre à cette question, et en attendant les résultats des études cliniques de terrain qui ne seront publiés que dans quelques jours ou semaines, les chercheurs se sont tournés vers les études animales et cellulaires in vitro.
Le taux de Omicron dans les tissus pulmonaires profonds est beaucoup plus faible que celui des autres variants
Les trois études résumées ci-dessous montrent que le variant Omicron se retrouve à des niveaux réduits dans les tissus pulmonaires profonds par rapport aux autres variants.
Diamond et al. (The SARS-CoV-2 B.1.1.529 Omicron virus causes attenuated infection and disease in mice and hamsters. Research Square 2021) ont infecté des souris et des hamsters avec le variant Omicron et d'autres variants afin de suivre l'évolution de la maladie. Les différences ont été stupéfiantes : après quelques jours, la concentration de virus dans les poumons des animaux infectés par Omicron était au moins dix fois inférieure à celle des rongeurs infectés par d'autres variants.
Ces résultats ont été confirmés par d'autres.
McMahan et al. (Reduced Pathogenicity of the SARS-CoV-2 Omicron Variant in Hamsters. BioRxiv 2022) et Bentley et al. (SARS-CoV-2 Omicron-B.1.1.529 Variant leads to less severe disease than Pango B and Delta variants strains in a mouse model of severe COVID-19. BioRxiv 2021) ont également observé que, par rapport aux variants précédents, Omicron se retrouve à des niveaux réduits dans les cellules pulmonaires. Or, c'est dans les poumons que le coronavirus fait le plus de dégâts, et nous savons que l'infection pulmonaire peut déclencher une réponse immunitaire inflammatoire majeure (orage cytokinique) qui ravage les cellules infectées et non infectées, entraînant une nécrose du tissu et une privation d'oxygène (voir sur ce site la page "Comment meurt-on de la COVID-19").
Moins de cellules pulmonaires infectées pourrait donc signifier une maladie moins grave, mais la question est : pour quelle raison cette moindre infection des voies pulmonaires basses ?
En fait , la réponse à cette question pourrait se trouver dans le mécanisme d'entrée du variant Omicron dans les cellules. Ce mécanisme semble différent de celui des autres variants.
Rappel sur le mécanisme d'entrée du SARS-CoV-2 dans les cellules
L'entrée du SARS-CoV-2 dans les cellules peut se faire par deux voies distinctes 1 et 2 (voir figure ci-dessous; voir également sur ce site la page : "Entrée du virus dans les cellules").
Voie 1. Fusion à la surface des cellules après protéolyse par TMPRSS2.
Dans la première étape du processus d'entrée dans les cellules, le domaine de liaison au récepteur de la protéine S du virus se fixe avec une très forte affinité sur son récepteur, l’enzyme de conversion de l’angiotensine 2 (ACE2), une protéine de la membrane cellulaire. La protéine S est schématiquement divisée en deux parties S1 et S2. La partie S1 comprend le domaine de liaison au récepteur. La partie S2 est impliquée dans l’entrée proprement dite dans la cellule par un processus de fusion membranaire qui dépend du peptide de fusion. Dans la deuxième étape de l'entrée, lorsque la protéine S est fixée sur ACE2, un changement de conformation se produit, rendant celle-ci sensible aux protéases TMPRSS2 et/ou cathepsine L qui par clivage S1/S2 éliminent la partie S1 rendant ainsi le peptide de fusion accessible et permettant l’entrée proprement dite du virus dans la cellule par un processus de fusion entre la membrane virale et la membrane cellulaire. Ce processus se termine par l’introduction de l'ARN viral dans la cellule qui signe l'infection.
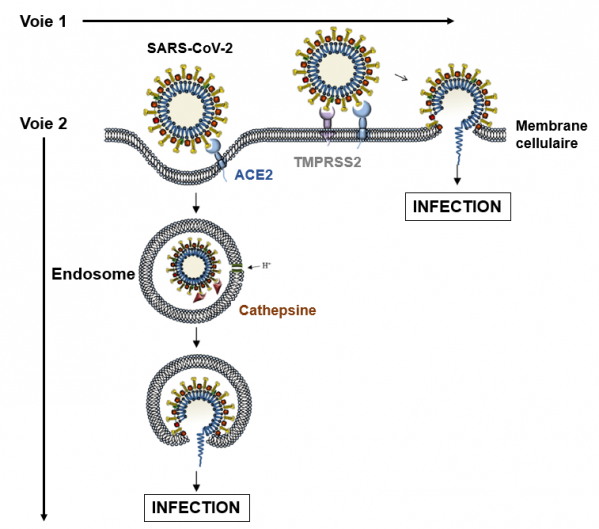
Les voies d'entrée du SARS-CoV-2 dans les cellules (Simmons et al. 2013)
Voie 2. Fusion par endocytose et activation après protéolyse par la Cathepsine L.
Les endosomes se forment par invagination de la membrane cellulaire lorsque la protéine S du virus se fixe sur son récepteur ACE2. Dans les endosomes, le pH diminue par entrée de protons. Ce processus conduit à l’activation de la cathepsine-L qui peut alors couper et activer la protéine S du virus, exposant ainsi le peptide de fusion. C’est par l’intermédiaire de ce peptide de fusion que la membrane du virus fusionne avec celle de l’endosome. La particule virale endocytosée peut libérer l'ARN viral dans la cellule.
Syncytium, pneumocytes et pathogénèse du SARS-CoV-2
Un syncytium est une cellule provenant de la fusion de plusieurs cellules (voir la figure ci-dessous). Outre les lésions caractéristiques des dommages dus à l'orage cytokinique (suractivation du système immunitaire, nécrose des pneumocytes, destruction des alvéoles pulmonaires et hypoxie) il a été observé que chez 90% des malades ayant fait une COVID-19 fatale, les pneumocytes pouvaient former des syncytiums contenant entre 2 et 20 noyaux cellulaires (Rajah et al. 2021; Bussani et al. 2020).
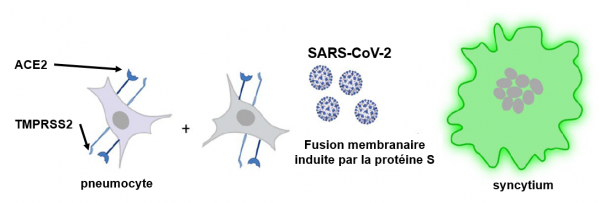
Formation d'un syncytium (Willett et al. 2022)
La protéine S du SARS-CoV-2 est directement impliquée dans la formation des syncytiums. Après avoir permis au virus de pénétrer à l'intérieur des cellules, elle est néosynthétisée et migre à la surfaces des cellules infectées. Là, elle est capable d'interagir avec la protéine ACE2 présente à la surface des cellules adjacentes, d'où la formation de fusion cellulaire et de syncytium. La fusion cellulaire médiée par la protéine S nécessite le clivage S1/S2, mais elle dépend également de la présence de la protéase TMPRSS2. La formation des syncytiums pourrait représenter pour le virus un moyen de se propager directement à d'autres cellules, à l'abri des anticorps neutralisants et d'autres acteurs du système immunitaire. Si on considère les variants du SARS-CoV-2 et en particulier leur protéine S, il apparaît que la capacité de cette protéine à former des syncytiums est corrélée à son affinité pour le récepteur ACE2. Les mutations individuelles hébergées par les variants Alpha, Beta, Gamma et Delta ont un impact significatif sur la fonction S et la formation de syncytium, à la fois individuellement et cumulativement. L'impact des syncytium dans la pathologie des variants émergents demeure une question en suspens, mais il est clair que leur formation est corrélée la pathogénicité du virus. Comment les diverses mutations affectent-elles la capacité de la protéine S des variants à former des syncytiums n'est pour l'heure pas encore établi et reste à être élucidé (Chaves-Medina et al. 2022).
Omicron pénètre dans les cellules de l'arbre respiratoire par un mécanisme différent de celui utilisé par tous les autres variants et produit moins de syncytiums
Les trois études résumées ci-dessous suggèrent fortement que le mécanisme d'entrée du variant Omicron dans les cellules de l'arbre respiratoire est différent de celui utilisé par tous les autres variants. Elles apportent par ailleurs des éléments permettant de répondre à la question de savoir quel est l'impact de Omicron sur la formation des syncytiums.
Meng et al. (SARS-CoV-2 Omicron spike mediated immune escape, infectivity and cell-cell fusion. BioRxiv 2021) montrent tout d'abord que par rapport au variant Delta, Omicron résiste de façon très significative aux anticorps neutralisants thérapeutiques monoclonaux et polyclonaux induits par deux doses de vaccin. Par contre, les anticorps produits par la troisième dose de vaccin entraînent une neutralisation du virus, au moins à court terme. Malgré trois mutations prédites pour favoriser le clivage S1/S2 de la protéine S, l'efficacité du clivage observée est nettement inférieure à celle de la protéine S du variant Delta. L'entrée du variant Omicron dans les organoïdes des voies respiratoires inférieures et les cellules pulmonaires Calu-3 est diminuée de plus de 10 fois par rapport au variant Delta. Dans les cellules pulmonaires exprimant la protéase TMPRSS2, le variant Omicron présente une réplication significativement plus faible que celle du Delta. En fait, la fusion cellulaire médiée par la protéine S de Omicron est fortement diminuée malgré l'expression de TMPRSS2 par rapport à la protéine S de Delta. Ces données in vitro indiquent qu'un clivage S1/S2 sous-optimal d'Omicron réduit l'efficacité de l'infection des cellules des voies aériennes inférieures exprimant TMPRSS2, mais pas des cellules négatives pour TMPRSS2 telles que celles trouvées dans les voies aériennes supérieures (épithélium nasal). Dans l'ensemble, Omicron semble avoir acquis d'importantes propriétés d'évasion immunitaire tout en modulant son tropisme cellulaire au profit de l'épithélium nasal plutôt que l'épithélium pulmonaire, et ceci pourrait avoir des implications importantes pour la transmission, la progression et la sévérité de la maladie in vivo.
Peacock et al (The SARS-CoV-2 variant, Omicron, shows rapid replication in human primary nasal epithelial cultures and efficiently uses the endosomal route of entry. BioRxiv 2021)
La protéine S de Omicron utilise l'ACE2 humaine comme récepteur primaire et pénètre plus facilement que les autres variants dans les cellules animales (espèces aviaires domestiques, chauves-souris et des souris) exprimant ACE2 ce qui suggère qu'il a une propension accrue à la zoonose inverse et qu'il est plus susceptible d'établir un réservoir animal du SARS-CoV-2. Cependant, contrairement aux autres variants du SARS-CoV-2, la protéine S de Omicron est capable de pénétrer efficacement dans les cellules de manière indépendante du TMPRSS2, par la voie endosomale dépendante de la cathepsine. Cela permet à Omicron d'infecter un grand nombre de cellules dans les voies hautes de l'épithélium respiratoire (épithélium nasal) dans lesquelles la protéine corécepteur TMPRSS2 n'est que très peu exprimée. En outre, la protéine S de Omicron a une capacité réduite à induire la fusion entre membrane virale et membrane cellulaire et entre les membranes cellulaires et en particulier donc, la formation de syncytium. Ce dernier point est concordant avec le fait que Omicron semble être moins pathogène que les autres variants pour lesquels la protéine S est très performante dans la formation de syncytiums.
Willett et al. (The hyper-transmissible SARS-CoV-2 Omicron variant exhibits significant antigenic change, vaccine escape and a switch in cell entry mechanism. MedRxiv 2022)
Cette étude montre à la fois une diminution marquée de la neutralisation dans les tests sérologiques et une perte d'efficacité réelle du vaccin chez les personnes ayant reçu deux doses de vaccin, l'efficacité étant partiellement récupérée par une troisième dose de rappel des vaccins à ARN. Les auteurs montrent également que l'immunité due à une infection naturelle (sans vaccination) est plus protectrice que deux doses de vaccin, mais inférieure à trois doses.
La constellation de mutations dans la protéine S de Omicron suggère des modifications fonctionnelles importantes qui pourraient rendre compte de sa transmission rapide. De fait ces auteurs montrent que Omicron n'induit pas la fusion cellule-cellule qui conduit à la formation de syncytium, contrairement aux autres variants et en particulier au variant Delta. La réplication de Omicron est beaucoup plus faible dans les cellules de l'épithélium pulmonaire que dans les cellules de l'épithélium nasal. Enfin, l'étude rapporte des changements fondamentaux dans le processus d'entrée du variant Omicron dans les cellules de l'arbre respiratoire. Alors que dans les variants Wuhan, Delta et les autres la protéine S est optimisée pour une entrée dans les cellules par fusion membrane virus-membrane cellulaire dépendante de TMPRSS2 (voie 1 de la figure plus haut), la protéine S de Omicron est optimisée pour une entrée via la voie endosomale (voie 2).
En conclusion
- Du fait du grand nombre des mutations qu'il porte, le variant Omicron manifeste un changement majeur dans l'antigénicité et la fonction biologique du virus SARS-CoV-2.
- L'échappement immunitaire important de ce variant chez les personnes doublement vaccinées est partiellement récupéré après une troisième dose de rappel des vaccins à ARNm.
- Omicron infecte préférentiellement les cellules de l'épithélium nasal (dans lesquelles la protéine TMPRSS2 est peu ou pas exprimée) et moins celles de l'épithélium pulmonaire (pneumocytes).
- Cette caractéristique permettrait à Omicron d'avoir une meilleure transmissibilité intrinsèque et d'être plus infectieux à des doses d'exposition plus faibles.
- Omicron utilise préférentiellement une voie d'entrée endosomale dans les cellules (dépendant de la cathepsine), contrairement à la voie de fusion membranaire (dépendante de la TMPRSS2) utilisée par les autres variants du SARS-CoV-2 étudiés jusqu'ici.
- Cette modification du processus d'entrée cellulaire fournit une explication mécanistique au fait que la formation des syncytiums est fortement réduite en réponse au variant Omicron par rapport aux autres variants.
- L'ensemble de ces résultats permet d'expliquer pourquoi Omicron est plus contagieux mais moins pathogène que les autres variants.
Les études rapportées dans ce post ont été déposées sur des plateformes de publications non encore revues par les pairs, Research Square, BioRxiv et MedRxiv. Cela signifie qu'il faudra attendre leurs publications dans des revues à comité de lecture pour valider pleinement leurs conclusions. Cependant, le fait qu'elles proviennent de groupe de recherche différents, qu'elles sont toutes concordantes et ne présentent pas de désaccords dans leurs conclusions encourage à une confiance raisonnable.
A suivre…
Le variant Omicron : dernières données au 16 décembre 2021
Omicron a maintenant été détecté dans plus de 70 pays et gagne rapidement du terrain. Par exemple, les scientifiques danois estiment que le variant Omicron est seulement à quelques jours de remplacer le variant Delta. Malgré des taux de vaccination très élevés, ce pays de 5 millions d'habitants enregistre désormais plus de 6 000 cas par jour, soit environ deux fois plus que lors du précédent pic le plus élevé. La Norvège voisine, qui a à peu près la même population, prévoit maintenant plus de 100 000 cas par jour en quelques semaines, à moins que les gens ne réduisent radicalement leurs contacts sociaux.
Je rappelle ici une fois encore qu'il ne faut pas confondre le nombre de cas détecté chaque jour par PCR, et le nombre de personnes malades.
Même si le variant Omicron provoque une maladie plus bénigne que le Delta, comme certains scientifiques l'espèrent, la possibilité d'un nombre de cas très élevés dans les mois à venir fait craindre des perspectives relativement sombres.
Pour les virologues, immunologistes et épidémiologistes, Omicron risque d'accélérer la pandémie, juste avant les vacances de fin d'année. Comme pour les variants précédents, une poignée de pays fournissent au monde la plupart des premières données. L'Afrique du Sud, où les scientifiques ont observé pour la première fois la propagation d'Omicron, a séquencé un grand nombre de génomes et produit des données sur les premiers cas. Le Danemark, qui dispose de l'un des meilleurs systèmes de surveillance génomique au monde a permis de documenter la manière dont le variant Omicron pourrait exploser en plus d'une poussée du variant Delta. Au Royaume-Uni, les scientifiques mènent toute une série d'études pour déterminer le degré de transmission du variant Omicron dans les foyers et ailleurs, ainsi que l'efficacité des vaccins contre ce variant.
Dans la figure ci-dessous, j'ai comparé la séquence de la protéine S des variants Omicron et Delta afin d'en montrer les mutations.


Les séquences de la protéine S des variants Omicron et Delta sont représentées ici (source le site CoVariants GISAID) selon le code des acides aminés à une lettre: Alanine A, Arginine R, Acide Aspartique D, Asparagine N, Cysteine C, Acide Glutamique E, Glutamine Q, Glycine G, Histide H, Isoleucine I, Leucine L, Lysine K, Methionine M, Phenylalanine F, Proline P, Serine S, Threonine T, Tryptophane W, Tyrosine Y, et Valine V. La partie soulignée représente le domaine de liaison de la protéine S au récepteur ACE2. La partie soulignée en gras représente le motif (le coeur) de liaison de la protéine S au récepteur ACE2. Les mutations par rapport à la séquence de référence de l'original (Wuhan 2019) sur surlignées en jaune. La protéine S comporte 1273 acides aminés.
On voit très clairement que de nombreuses mutations se sont accumulées dans le gène viral codant pour la protéine S du variant Omicron. D'autres mutations (non montrées ici) se sont également accumulées dans d'autres gènes du virus; cependant c'est dans le gène codant pour la protéine S que leur nombre est largement maximal. Dès lors, il est aisé de comprendre l'inquiétude des scientifiques. En effet, les vaccins utilisés actuellement ont été fabriqués pour cibler la séquence de la protéine S du variant "original" (Wuhan 2019). Malgré les 11 mutations sur cette protéine du variant Delta, les anticorps semblent efficaces au moins en ce qui concerne les formes sévères nécessitant une hospitalisation. Mais qu'en sera-t-il du variant Omicron dont la protéine S affiche une séquence encore plus éloignée de l'originale du Wuhan 2019 avec au moins 31 mutations dont 10 dans le domaine de liaison de cette protéine au récepteur ACE2, et 3 délétions ?
Bien que des études publiées manquent encore (travaux en cours), des données préliminaires provenant d'Afrique du Sud montrent que l'apparition du variant Omicron coïncide avec une augmentation inattendue des réinfections. Récemment, des essais en laboratoire menés par plusieurs groupes ont montré que les anticorps, qu'ils soient produits en réponse aux vaccins ou à une infection antérieure, sont nettement moins efficaces pour neutraliser Omicron que d'autres variants. Et sur la base des premiers cas, des scientifiques du Royaume-Uni ont estimé que la protection contre la maladie symptomatique est beaucoup plus faible chez les personnes qui ont reçu deux doses des vaccins AstraZeneca ou des vaccins à ARN messager. La bonne nouvelle est que les rappels semblent ramener la protection contre la maladie à environ 75 %, et probablement encore plus contre l'hospitalisation. Mais ces résultats doivent être confirmés.
Les premières données de Discovery, la plus grande compagnie d'assurance maladie d'Afrique du Sud, présentées le 14 décembre, ont rassuré sur le fait que l'évasion immunitaire du variant Omicron n'est pas totale. Ces données montrent que les admissions à l'hôpital dans le pays augmentent plus lentement que lors des vagues précédentes. Cela pourrait signifier que la protection contre les formes de COVID-19 graves est encore solide chez les personnes vaccinées et rétablies, ou que le virus est par nature un peu moins pathogène que le variant Delta. Mais il faut encore rester prudent.
Les scientifiques craignent également que le variant Omicron qui présente un nombre important de mutations génomiques par rapport aux autres variants connus puisse apporter d'autres surprises évolutives désagréables. Par exemple, environ un génome du variant Omicron séquencé sur 10 jusqu'à présent présentent une mutation supplémentaire dans la protéine Spike appelée R346K, qui devrait lui permettre d'échapper encore mieux au système immunitaire. Selon Stephen Goldstein, virologue à l'université de l'Utah (USA), Omicron possède déjà la plupart des meilleurs atouts pour échapper aux anticorps, il n'y a donc pas beaucoup d'ajouts possibles, et la mutation R346K en fait partie.
A suivre…
Bibliographie
- CoVariants GISAID (https://covariants.org/variants/21K.Omicron)
- Kupferschmidt, Science 2021
Le variant Omicron : données du 6 décembre 2021
La plupart des discours sur Omicron sont assez alarmistes et ont déjà conduit les états à des prises de décision abruptes telles que des fermetures des frontières. Les nouvelles enregistrées depuis quelques jours se veulent pourtant plus rassurantes. D'après les premiers retours des médecins Sud-Africains sur le terrain, le variant Omicron semble assez peu pathogène. C’est ce qu’affirme notamment le Dr Angélique Coetzee, présidente de l’Association Médicale d’Afrique du Sud dans une interview sur CNBC.
Le variant Omicron pourrait-il être à la fois plus contagieux et moins virulent ? Certains le pensent. La prudence reste cependant de mise : ces observations rassurantes ont été faites sur très peu de patients souvent jeunes et il n’y a aucune règle selon laquelle un variant plus contagieux serait nécessairement moins pathogène. Le variant Delta, 50 % plus contagieux que le variant Alpha, est tout aussi dangereux que son prédécesseur. Comme souvent avec la COVID-19, l’incertitude est totale et les réponses se font attendre.
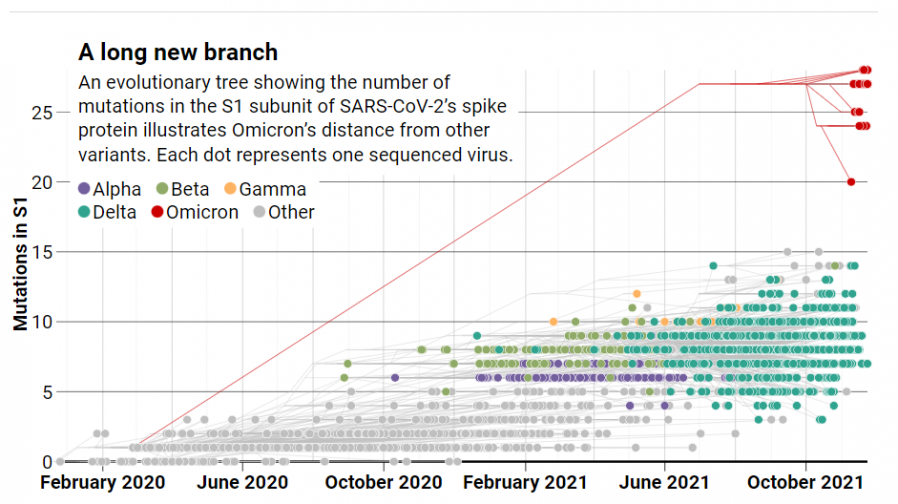
Arbre phylogénétique du SARS-CoV-2
Cet arbre est basé sur les séquences ADN du gène codant pour le protéine S (Spyke) montrant les relations évolutives entre les divers variants sur la base des similitudes et différences dans leurs caractéristiques génétiques. La séquence ancêtre commun est celle du virus "original" Wuhan 2019. Chaque cercle de couleur représente une séquence codant pour la protéine S du virus issue d'un prélèvement sur un malade. On peut voir la "filiation" entre les diverses séquences des variants, excepté pour les séquences du variant Omicron qui ne semblent "affiliées" a aucun variant connu à ce jour.
Il est clair que le variant Omicron ne s'est pas développé à partir de l'un des variants préoccupants antérieurs, comme le variant Alpha ou le Delta, comme le montre la figure ci-dessus. Au contraire, il semble avoir évolué en parallèle et dans l'ombre. Le variant Omicron est si différent des millions de génomes du SRAS-CoV-2 qui ont été séquencés et partagés publiquement qu'il est difficile d'identifier son plus proche parent. Emma Hodcroft, virologue à l'Université de Berne estime que le virus a probablement divergé très tôt des autres souches et que sa "naissance" pourrait remonter à la mi-2020.
Cette hypothèse soulève la question de savoir où les prédécesseurs d'Omicron se sont cachés pendant plus d'un an.
Les scientifiques voient essentiellement trois explications possibles :
- Le virus pourrait avoir circulé et évolué dans une population peu surveillée et où les variants sont peu (ou pas) séquencés.
- Il a pu se développer chez un patient immunodéprimé atteint d'une COVID-19 chronique (par exemple malades du SIDA).
- Il a pu évoluer chez une espèce animale d'où il s'est récemment répandu chez l'homme.
Christian Drosten, virologue à l'hôpital universitaire Charité de Berlin, privilégie la première possibilité. Le virus pourrait avoir évolué non pas en Afrique du Sud, où de nombreux séquençages sont en cours, mais ailleurs en Afrique australe pendant la vague hivernale. Mais d'autres chercheurs comme Andrew Rambaut de l'Université d'Édimbourg, ne voient pas comment le virus a pu rester caché dans un groupe de personnes pendant si longtemps. Pour lui, le virus se serait plus probablement développé chez un patient atteint d'une COVID-19 chronique, probablement une personne dont la réponse immunitaire a été altérée par une autre maladie ou un médicament. Lorsque le variant Alpha a été découvert à la fin de 2020, ce variant semblait également avoir acquis de nombreuses mutations en une seule fois, ce qui a conduit les chercheurs à postuler une infection chronique. Cette idée est étayée par le séquençage d'échantillons de SRAS-CoV-2 provenant de certains patients atteints d'une infection chronique. Il faut ici rappeler que le VIH (virus du SIDA) sévit largement en Afrique du Sud et qu'il entraîne une déficience immunitaire chez les malades. En support à cette possibilité Richard Lessells, chercheur en maladies infectieuses à l'université de KwaZulu-Natal, publie qu'une jeune femme d'Afrique du Sud atteinte d'une infection par le VIH non contrôlée a été porteuse du virus SRAS-CoV-2 pendant plus de six mois. Le virus a accumulé bon nombre des modifications observées dans les variants préoccupants. Ce schéma a également été observé chez un autre patient dont l'infection par le SRAS-Cov-2 a persisté encore plus longtemps.
Enfin, certains suggèrent que le virus s'est peut-être caché chez des rongeurs ou d'autres animaux, plutôt que chez l'homme, et qu'il a donc subi des pressions évolutives différentes qui ont sélectionné de nouvelles mutations. Selon Kristian Andersen, chercheur en maladies infectieuses au Scripps Research aux USA, le génome est extrêmement bizarre avec un pot-pourri de mutations, dont beaucoup n'ont jamais été observées auparavant dans d'autres variants. De fait, Mike Worobey biologiste de l'évolution à l'université d'Arizona à Tucson, USA, indique que 80 % des cerfs de Virginie échantillonnés entre fin novembre 2020 et début janvier 2021 étaient porteurs du SRAS-CoV-2.
Pour l'instant, l'origine du variant Omicron reste inconnue.
À quelle vitesse le variant Omicron se propage-t-il ?
C'est ce qui inquiète les chercheurs, car une propagation rapide pourrait déclencher une augmentation explosive des cas de COVID-19. Le 1er décembre, l'Afrique du Sud a enregistré 8 561 cas, contre 3 402 le 26 novembre et plusieurs centaines par jour à la mi-novembre. La majeure partie de cette augmentation a eu lieu dans la province de Gauteng (Johannesburg). Fin novembre, l'Institut national sud-africain des maladies transmissibles (NICD) de Johannesburg a déterminé que R (le nombre moyen de nouveaux cas engendrés par chaque infection) était supérieur à 2 à Gauteng. Or, ce R était bien inférieur à 1 en septembre, lorsque le variant Delta était prédominant et que le nombre de cas diminuait. Ceci suggère que le variant Omicron a le potentiel de se propager beaucoup plus rapidement et d'infecter beaucoup plus de personnes que le Delta.
La surveillance accrue en Afrique du Sud pourrait amener les chercheurs à surestimer la croissance rapide d'Omicron. Mais si ce schéma se répète dans d'autres pays, ce serait une preuve très forte qu'Omicron a un avantage en matière de transmission. Si cela ne se produit pas, par exemple, dans les pays européens, cela signifierait que les choses sont un peu plus complexes et dépendent fortement du paysage immunologique. Il est donc nécessaire d'attendre.
Bien que le séquençage du génome soit nécessaire pour confirmer les cas d'Omicron, certains tests PCR peuvent détecter un signal caractéristique du variant qui le distingue de Delta. Sur la base de ce signal, il existe des indications préliminaires selon lesquelles les cas, bien qu'extrêmement faibles en nombre, sont en augmentation au Royaume-Uni (Christian Althaus epidemiologiste, Université de Bern, Suisse).
Le variant Omicron peut-il surmonter l'immunité des vaccins ou des infections antérieures ?
La détection rapide du variant en Afrique du Sud laisse penser qu'il a une certaine capacité à échapper à l'immunité. Environ un quart des Sud-Africains sont entièrement vaccinés et il est probable qu'une grande partie de la population a été infectée par le SRAS-CoV-2 lors de vagues antérieures, compte tenu de l'augmentation des taux de mortalité depuis le début de la pandémie. Dans ce contexte, le succès d'Omicron en Afrique australe pourrait être dû en grande partie à sa capacité à infecter les personnes qui se sont remises de la COVID-19 causé par le variant Delta ou d'autres variants, ainsi que celles qui ont été vaccinées.
Les chercheurs se focalisent aujourd'hui sur des expériences permettant d'estimer la capacité d'Omicron à échapper aux réponses immunitaires et à la protection qu'elles offrent. Pour cela des cellules humaines porteuses de l'ACE2 (le récepteur du SARS-CoV-2) sont infectées par des virions du variant Omicron ou des pseudovirus porteurs de mêmes mutations que le variant Omicron, en absence et en présences de divers anticorps neutralisants anti-SARS-CoV-2. Les résultats seront publiés dans les semaines qui viennent.
Comment les vaccins se comporteront-ils face au variant Omicron ?
Si le variant Omicron peut se jouer des anticorps neutralisants, cela ne signifie pas pour autant que les réponses immunitaires déclenchées par la vaccination et/ou une infection antérieure n'offriront aucune protection. En effet les anticorps neutralisants ne sont qu'un des acteurs principaux de l'immunité. Les lymphocytes T cytotoxiques et les cellules tueuses naturelles, qui détruisent toute cellule infectée par le virus sont d'autres acteurs majeurs du système immunitaire. Ces cellules pourraient être moins affectés par les mutations du variant Omicron que les réponses aux anticorps. Les chercheurs sud-africains prévoient de mesurer l'activité de ces cellules qui pourraient être particulièrement importantes pour la protection contre la COVID-19 sévère. Les observations déjà largement documentées avec le variant Delta montrent une protection important des vaccins contre les hospitalisations en dépit d'une diminution de l'effet neutralisant des anticorps. Cependant, il existe aujourd'hui un déséquilibre important entre le nombre des cas détectés dans la population et le nombre des hospitalisations en soins intensifs (et des décès). Les premiers rapports des cliniciens Sud-Africains qui suggèrent que la plupart des infections liées au variant Omicron ont été légères sont un signal positif.
Les rappels actuels amélioreront-ils la protection contre le variant Omicron ?
La menace due à ce variant a incité divers pays comme le notre à élargir le déploiement des doses de rappel des vaccins anti-COVID. Mais on ne sait pas encore quelle sera l'efficacité de ces doses contre ce variant. On sait par contre que le rappel augmente le niveau des anticorps neutralisants, et il est probable que cela constituera un rempart contre la capacité du variant Omicron à échapper à ces anticorps. Une étude récente de Bieniasz et al. (Nature 2021) a révélé que les personnes qui s'étaient remises du COVID-19 plusieurs mois avant de recevoir leurs vaccins avaient des anticorps capables de bloquer des variants porteurs d'une protéine S (Spyke) polymutante hautement résistante du SRAS-CoV-2, ou diverses protéines S d'autres sarbecovirus. Ainsi, les anticorps polyclonaux humains contre le SRAS-CoV-2, produits de manière optimale, devraient être résistants aux variants du SRAS-CoV-2 et pourraient conférer une protection contre d'éventuelles pandémies de sarbecovirus.
Le variant Omicron provoque-t-il une maladie plus bénigne ou plus grave que les variants précédents ?
Les premiers rapports associaient le variant Omicron à une maladie bénigne, ce qui laissait espérer que ce variant pourrait être moins pathogène que certaines de ses prédécesseurs. Mais ces rapports, qui reposent souvent sur des données anecdotiques ou issues de faibles cohortes, peuvent être trompeurs. Ils doivent donc être considérés avec prudence.
Un problème majeur dans l'évaluation de la gravité d'un variant est de savoir comment contrôler les nombreux paramètres qui peuvent influencer l'évolution de la maladie, en particulier lorsque les épidémies sont géographiquement localisées. Par exemple, les rapports faisant état d'une maladie bénigne due à l'infection par le variant Omicron en Afrique du Sud pourraient s'expliquer par le fait que le pays a une population relativement jeune, dont beaucoup ont déjà été exposés au SRAS-CoV-2. Un autre exemple est qu'au début de l'épidémie due au variant Delta, il a été signalé que ce variant provoquait une maladie plus grave chez les enfants que les autres variants. Cette hypothèse s'est effondrée lorsque davantage de données ont été collectées.
Il faut rechercher des données sur les infections par le variant Omicron dans d'autres pays. Cette répartition géographique et l'augmentation de la taille de l'échantillon au fur et à mesure que les cas s'accumuleront permettront aux chercheurs d'avoir une meilleure idée sur la pathogénie (faible ou élevée) de ce variant. Cela prendra du temps. C'est ce qui s'est passé avec le variant Delta.
A suivre…
Bibliographie
Kupferschmidt. Science 2021
Callaway and Ledford. Nature 2021
Date de dernière mise à jour : 13/01/2022
Commentaires
-

- 1. RenataSpout Le 29/11/2025
This post brought up something powerful—how behavior change starts with the tiniest decisions we often overlook.
If you're looking for a proven way to take control of your habits without burning out, this book is a game-changer. It teaches you how to make tiny changes that lead to remarkable results in productivity, mindset, and motivation.
What makes this book different is that it focuses on minimum viable habits—just tiny actions that remove resistance and help you stick with real goals over time.
������ You can read more and get the book here:
https://www.hotelreceptionisttraining.com/2025/05/mini-habits-major-results-simple-proven.html
If you’re ready to stop struggling with willpower and start seeing results through smart, simple steps—this might be the proven way you've been waiting for.
This book changed the way I think about habit formation—and honestly, it helped me change my life.
Ajouter un commentaire
