Alzheimer, nouvelle hypothèse
L’accumulation de lipides dans les cellules microgliales pourrait être la cause première de la maladie d'Alzheimer
La communication originale par le docteur Alois Alzheimer de ce qui sera plus tard connu sous le nom de maladie d’Alzheimer faisait état de nombreuses cellules microgliales présentant des « saccules adipeux » dans le cerveau de patients atteints de démence (Première communication sur cette maladie ; 37ème Meeting des aliénistes Allemands, Tübingen, 3-4 Novembre 1906).
La maladie d’Alzheimer
Nous connaissons aujourd’hui les signes cliniques les plus marquants de la maladie d’Alzheimer : perte progressive de la mémoire de court terme et d’autres fonctions cognitives, déficit cognitif léger, incapacité à acquérir de nouvelles informations, apathie, anxiété et dépression. Cette situation clinique est liée à la perte de neurones notamment au niveau du cortex cérébral et de certaines régions sous-corticales (hippocampe).
Les causes de cette maladie restent mal connues même si les nombreuses études cliniques qui lui ont été consacrées ont mis en lumière trois facteurs de risque génétiques associés à son développement : i) l’apparition de plaques de b-amyloïdes entre les neurones, ii) l’apparition de réseaux neurofibrillaires de la protéine Tau à l’intérieur des neurones, et iii) la présence chez le malade du variant APOE4 de l’apolipoprotéine E (Huang et al. 2012, Cell). Ainsi, la plupart des travaux visant à mettre au point des stratégies thérapeutiques pour prévenir, ralentir ou arrêter la maladie ont été basés sur la réduction ou l'élimination de ces accumulations de b-amyloïdes et de réseaux de protéine Tau, mais malheureusement sans réel succès. De fait, diverses études ont montré que ces marqueurs, pris un par un, ne sont pas à eux seuls responsables du développement de la maladie et semblent plutôt jouer un rôle « d’accompagnateur » dans le cours de son développement (Wang, 2023, Front Immunol ; Wang, 2016, Nature).
Etat des connaissances sur les causes de la maladie
Les cellules du cerveau
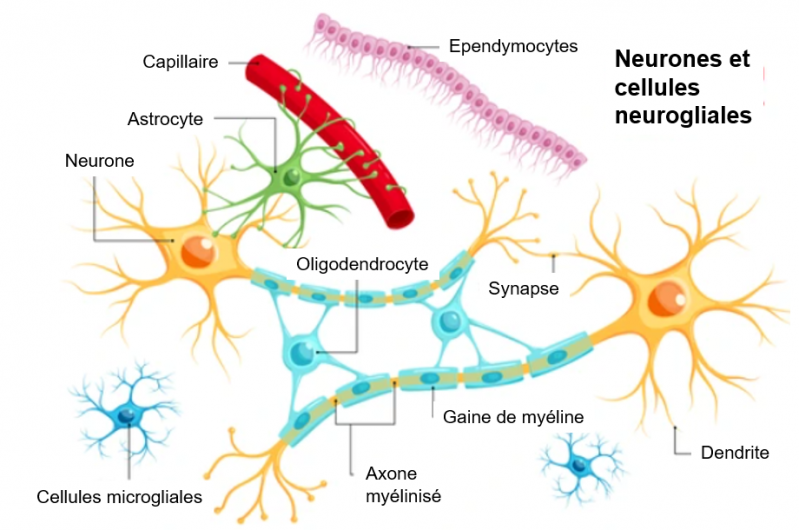
Le cerveau comporte cinq grands types de cellules. Les neurones sont les cellules dites « nobles » du cerveau, responsables entre-autre des performances cognitives et émotionnelles humaines. Schématiquement, les autres types cellulaires constituent les cellules neurogliales qui constituent l'environnement des neurones en assurant le maintien de leur homéostasie. Les oligodendrocytes produisent la myéline (couche isolante sur les axones des neurones) ; les astrocytes apportent les nutriments et l'oxygène, assurent la barrière hématoencéphalique et interviennent dans le fonctionnement des synapses ; les épendymocytes assurent l'interface entre le système nerveux et le liquide cérébrospinal ; enfin, les cellules microgliales sont des macrophages résidents qui éliminent les cellules mortes et combattent les pathogènes du fait de leurs capacités phagocytaires. Collectivement, l’ensemble des cellules gliales représentent environ 50 % du volume cérébral et des cellules du cerveau. (Source de la figure: Latham, Brain cells, Biology dictionary).
Les plaques de b-amyloïdes entre les neurones
Diverses maladies (Alzheimer, Parkinson, Huntington, Prion, etc.) sont dues à des agrégats pathologiques de protéines qui adoptent un repliement anormal, du fait de mutations ou autres modifications, leur permettant de s’agglutiner les unes aux autres. Il se constitue alors un polymère qui peut compter des centaines à plusieurs milliers de molécules de la protéine en question. Ces polymères forment des fibrilles dont la présence au sein des cellules ou des tissus en affectent gravement le fonctionnement entraînant ainsi la maladie. Dans la maladie d’Alzheimer, une plaque amyloïde est une accumulation extracellulaire (entre les neurones) de bêta-amyloïde ou d'autres substances amyloïdes, résultant du clivage de la protéine précurseur de l'amyloïde (APP) par la sécrétase BACE1 (Cho et al. 2022, Pharmacol Ther; Taylor et al., 2022, Obes Rev).
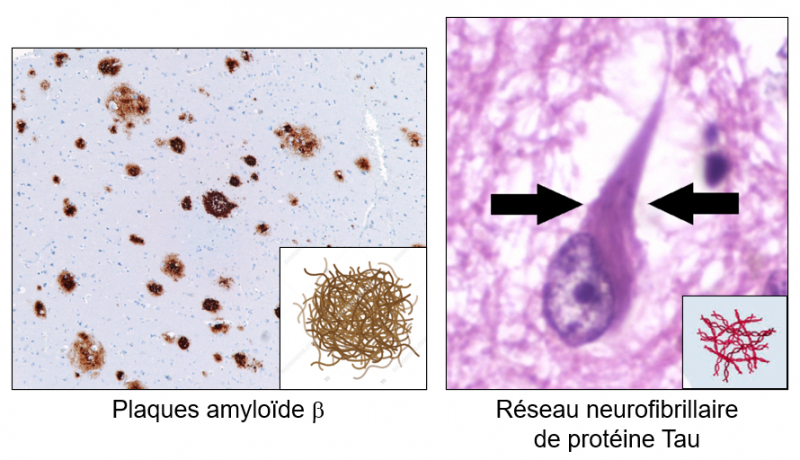
Figure. Les plaques amyloides et le réseau fibrillire de la protéine Tau (Sources de la figure; gauche: Wikimedia Commons, et droite Mikael Häggström).
Les réseaux neurofibrillaires de la protéine Tau à l’intérieur des neurones
La protéine Tau fait partie de la famille des protéines associées aux microtubules, fibres constitutives du cytosquelette des cellules et notamment présentes dans les neurones. Une de ses principales fonctions est de moduler la stabilité des microtubules des axones et des dendrites. La protéine Tau est une phosphoprotéine qui contient environ 80 sites de fixation du groupe phosphate. Sa phosphorylation est étroitement contrôlée car son degré de phosphorylation impacte la stabilité des microtubues. L'hyperphosphorylation de la protéine Tau déstabilise les microtubules et peut entraîner son auto agrégation sous forme de réseau de neurofibrille au sein des neurones, phénomènes impliqués dans la pathogenèse de la maladie d'Alzheimer et d'autres maladies neurodégénératives (tauopathies). (Ashton et al. 2024, JAMA Neurol).
La protéine APOE
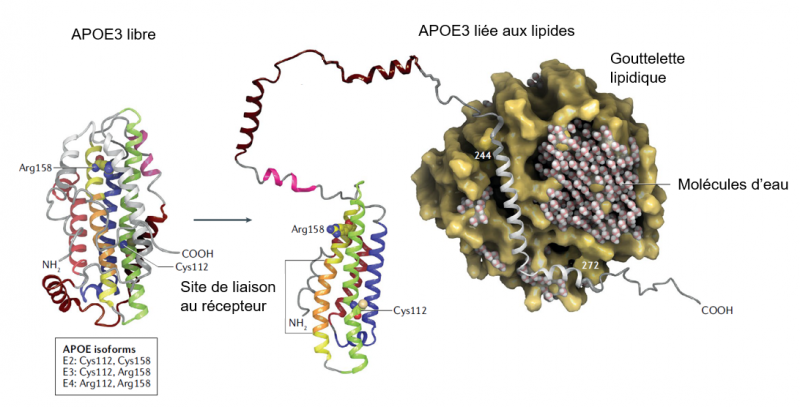
Figure. La protéine APOE3 en crystallographie aux rayons X dans sa forme libre et liée à une gouttelette de lipides (Source: Yamazaki et al. 2019)
APOE est une protéine impliquée dans le transport des lipides, du cholestérol et des vitamines A, D et E. Le gène APOE codant pour cette protéine est polymorphe avec trois allèles (variants) principaux APOE2, APOE3 et APOE4, respectivement présents dans 7, 75 et 15% de la population générale. Bien que ces variants ne diffèrent les uns des autres que par un ou deux acides aminés, ces différences modifient la structure et la fonction de l'APOE. Le variant APOE4 et en particulier le génotype APOE4/4 (deux allèles) est un facteur de risque pour la maladie d’Alzheimer (Yamazaki et al. 2019, Nature Rev Neurology).
Une nouvelle hypothèse sur la cause de la maladie
Un article, publié ce mois-ci dans la revue internationale Nature, identifie un nouveau coupable potentiel pour la maladie d'Alzheimer. Il pourrait s’agir d’une accumulation de gouttelettes lipidiques et de triglycérides dans les cellules microgliales, impliquées dans l’immunité innée dans le système nerveux central (Haney et al. Nature 2024).
Résultats de l'étude de Haney et al. 2024, Nature
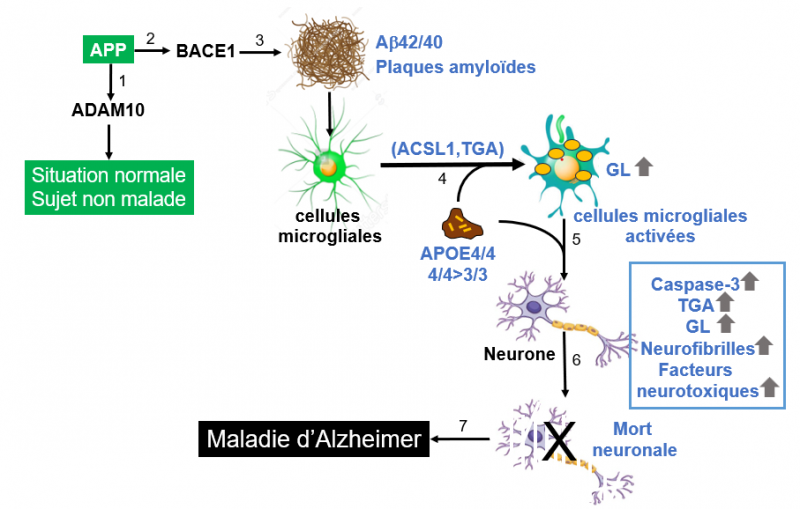
Figure. Principaux résultats de l’étude de Haney et al. 2024, publiée dans la revue internationale Nature le 13 mars dernier.
APP est la protéine précurseur de l’amyloïde b. Elle est codée par le gène APP. Il s’agit d’une protéine membranaire qui s’exprime dans divers tissus et principalement dans les synapses et joue un rôle majeur dans la physiologie neuronale. Dans le cerveau adulte, l'APP régule la croissance et la maturation des neurones, la formation et la fonction des synapses.
1. Dans les conditions normales (absence de la maladie), l’APP est coupée par une protéase, l’a-sécrétase (ADAM10), puis par une autre protéase, la g-sécrétase (non mentionnée sur la figure). Les peptides générés sont exempts de neurotoxicité.
2 et 3. Dans la voie qui conduit à la maladie, l’APP est coupé par une protéase, la b-sécrétase (BACE1), puis par une autre protéase, la g-sécrétase (non mentionnée sur la figure). Plusieurs peptides sont générés et notamment le peptide b-amyloïde (b42, 42 acides aminés) neurotoxique qui forme des agrégats, conduisant à la formation des plaques amyloïdes se formant entre les neurones et présentes dans le cerveau des malades. Les deux voies alternatives 1 et 2 dépendent de divers phénomènes multigéniques : mutations sur le gène APP, régulation de l’expression du gène BACE1, mutations sur le gène ADAM10, mutations sur le gène APOE avec le variant APOE4 qui semble déterminant, etc.
4. Les cellules microgliales (macrophages résidents du système nerveux central dont elles représentent entre 10 et 15% de la population cellulaire) sont impliquées dans l’immunité innée (Voir la page Immunologie sur ce site). C’est à dire qu’elles s’activent dès la présence de signaux d’alerte et d’inflammation dans le tissu tels que la présence des plaques amyloïdes ou les infections bactériennes ou virales. Cette activation des cellules microgliales s’accompagne de la formation de gouttelettes lipidiques (GL, petits cercles de couleur jaune sur la figure) et de triglycérides (TGA) générées par l’action l’enzyme ACSL1 (acyl-CoA synthetase long-chain family member 1).
5 et 6. A la suite de cette activation, les cellules microgliales induisent une réponse des neurones caractérisée par une augmentation du niveau de caspase-3 (une protéine impliquée dans la mort cellulaire programmée), de triglycérides, de gouttelettes lipidiques, de neurofibrilles dues à la protéine Tau phosphorylée (un marqueur historique de la maladie) et de facteurs neurotoxiques. Cette réponse conduit à la mort des neurones et à la maladie.
4et 5. Dans ces étapes (activation des cellules microgliales et réponse subséquente des neurones) la protéine APOE joue un rôle déterminant et en particulier d’autant plus important que le malade est porteur du génotype APOE4/4 (par rapport au génotype APOE3/3).
Conclusion
Jusqu’ici, les plaques amyloïdes (peptide amyloïde b), les réseaux de neurofibrilles (protéine Tau) et le génotype APOE4 ont été le plus fréquemment impliqués dans l’étiologie de la maladie d’Alzheimer, mais n’ont pas permis de mettre en place une stratégie thérapeutique efficace. Cette étude propose une nouvelle hypothèse sur le mécanisme responsable de la maladie. Activées par la présence des plaques amyloïdes, les cellules microgliales acquièrent un état pathologique (un dysfonctionnement) lié à l’expression de la protéine ACSL1, la production de triglycérides, l'accumulation de gouttelettes lipidiques de manière dépendante de l'APOE et la sécrétion de substances neurotoxiques qui en ciblant les neurones provoquent la maladie. Cette hypothèse est soutenue par des études récentes qui avaient déjà souligné le caractère dysfonctionnel et pro-inflammatoire des cellules microgliales chargées de gouttelettes lipidiques au cours du vieillissement dont on sait qu’il s’accompagne fréquemment de maladies neurodégénératives. De futures études doivent maintenant être entreprises pour confirmer cette hypothèse qui permettrait d’envisager de nouvelles approches thérapeutiques pour le traitement de cette maladie.
A suivre …
Pour aller plus loin
La description originale du docteur Alois Alzheimer de ce qui sera plus tard connu sous le nom de maladie d’Alzheimer faisait état nombreuses cellules microgliales présentant des « saccules adipeux » dans le cerveau de patients atteints de démence. Bien que la description de cette caractéristique pathologique de « cellules microgliale-chargées en lipides » ait été faite parallèlement à celle des plaques amyloïdes et des réseaux fibrillaires de la protéine Tau, communément associées à la maladie, elle n’a reçu que peu d'attention.
Les études d'association à l'échelle du génome (Genome Wide Association Studies) testent des centaines de milliers de variants génétiques sur de nombreux génomes afin de trouver ceux qui sont statistiquement associés à un trait ou à une maladie spécifique. Une telle méta-analyse, entreprise récemment sur des prélèvements de cerveau de malades Alzheimer, a identifié des gènes impliqués dans le métabolisme des lipides et l'immunité innée comme une catégorie statistiquement enrichie de facteurs de risque génétiques de la maladie, aux côtés des catégories plus caractéristiques comme le gène APP/amyloïde et le gène MAPT codant la protéine Tau (Kunkle et al. 2019, Nature Genetics; Andrews et al. 2023, EBioMedicine). Cependant, le rôle que jouent les lipides et l’immunité innée dans le risque de maladie d’Alzheimer reste mal compris.
On savait que plusieurs facteurs de risque génétiques de la maladie d'Alzheimer impliquent des gènes contribuant au métabolisme des lipides et nombre de ces gènes sont fortement exprimés dans les cellules microgliales (Victor et al. 2022, Cell Stem Cell 2022 ; Marschallinger et al. 2020, Nature Neuroscience). Cependant, la relation entre le métabolisme des lipides dans les cellules microgliales et la maladie d'Alzheimer n’est pas encore clairement établie.
Dans une première étape observationnelle, les chercheurs ont utilisé la méthodologie du séquençage unicellulaire de l'ARN dans des prélèvements congelés de tissu cérébral de malades obtenu post-mortem. Ils ont ainsi identifié un état pathologique des cellules microgliales caractérisé par l'expression de l'enzyme ACSL1 (acyl-CoA synthetase long-chain family member 1) responsable de la production de triglycérides et associée à la formation de gouttelettes lipidiques intracellulaires. Les analyses réalisées sur divers prélèvements cérébraux de ces malades (randomisés en fonction de l’âge et du sexe), atteints ou non par la maladie d’Alzheimer, ont montré que non seulement ces cellules microgliales étaient plus abondantes chez les malades porteurs homozygotes du génotype APOE4/4, par rapport aux malades et sujets contrôles (non atteints par la maladie) porteurs homozygotes du génotype APOE3/3, mais également qu’elles montraient des niveaux supérieurs de l’enzyme ACSL1 et de gouttelettes lipidiques.
Ces résultats montrent que les cellules microgliales chargées de gouttelettes lipidiques et exprimant l’ACSL1 sont beaucoup plus nombreuses dans le cerveau des malades que dans celui des sujets sains et qu’elles sont également d’autant plus nombreuses chez les malades porteurs du génotype APOE4/4.
Dans une deuxième étape fonctionnelle, les chercheurs ont généré des cellules microgliales issues de cellules souches pluripotentes induites humaines (dérivées du sang ou de la peau) provenant de malades porteurs du génotype APOE4/4, et par comparaison, sur ce même type de cellules issues de malades ou de sujets sains porteurs du génotype APOE3/3. Lorsque ces cellules ont été mise en contact avec le réseau fibrillaire de l'amyloïde β42, les plaques amyloïdes observées chez les malades, l'expression de l'ACSL1, la synthèse de triglycérides et l'accumulation de gouttelettes lipidiques intracellulaires ont été fortement augmentées d'une manière dépendante de l'APOE. C’est à dire que le génotype APOE4/4 produisait des niveaux supérieurs à ceux produits par le génotype APOE3/3.
Ces résultats montrent que l’accumulation de lipides dans les cellules microgliales est liée à la maladie d’Alzheimer.
Dans une troisième étape, les chercheurs ont généré des neurones issus de cellules souches pluripotentes induites humaines provenant de malades porteurs du génotype APOE4/4, et de malades ou de sujets sains porteurs du génotype APOE3/3 (comme il l’avaient fait précédemment pour les cellules microgliales). Ces neurones ont ensuite été exposés au milieu de culture baignant les cellules microgliales fortement chargées en gouttelettes lipidiques et divers marqueurs tels que le niveau de la protéine Tau phosphorylée, de la caspase-3 (acteur de l’apoptose), des triglycérides et des gouttelettes lipidiques et ont été analysés. Tous ces paramètres présentaient des niveaux plus élevés avec le génotype APOE4/4 qu’avec le génotype APOE3/3 alors qu’ils restaient inchangés avec les contrôles (sujets APOE3/3 non Alzheimer). A noter que l’ACSL1, l’enzyme génératrice des triglycérides n’était pas induite dans ces neurones.
Ces résultats montrent que les cellules microgliales fortement chargées en lipides transmettent ces lipides (triglycérides) aux neurones et induisent leur apoptose.
Conclusion
Sur la base de cet ensemble de résultats, les auteurs proposent une nouvelle hypothèse pour la pathogenèse de la maladie d’Alzheimer. Selon cette hypothèse, l'amyloïde β induit dans les cellules microgliales l’expression de ACSL1, la production de triglycérides, l'accumulation de gouttelettes lipidiques et la sécrétion de substances neurotoxiques de manière dépendante de l'APOE. Ces substances pourraient être transférés directement des cellules microgliales aux neurones provoquant ainsi leur dégénérescence.
Il est probable que le génotype APOE contribue à la pathogenèse de la maladie d'Alzheimer par le biais de plusieurs mécanismes distincts propres au fonctionnement de chaque type de cellule ou par le biais de perturbations entre les signaux échangés entre ces types de cellules. D'autres études sont nécessaires dans ce sens.
Un rapport récent a montré que les déclencheurs de l'immunité innée (par exemple, Escherichia coli et Salmonella) induisent la formation de gouttelettes lipidiques dans les macrophages périphériques dans le cadre d'une défense antimicrobienne, dans laquelle les gouttelettes de lipides recouvertes de protéines antimicrobiennes telles que la cathélicidine, tuent les bactéries (Bosch et al. 2020, Science). Une réponse similaire pourrait être déclenchée dans les cellules microgliales exposées à l'amyloïde β, aux lipopolysaccharides bactériens et à d'autres activateurs de l'immunité innée et perturber l'homéostasie cérébrale. De futures recherches sur le rôle bénéfique d'une stimulation spécifique de la lipophagie microgliale pourraient permettre de mieux élucider le rôles néfastes de ces cellules chargées en lipides dans la maladie d'Alzheimer et représenter une nouvelle stratégie thérapeutique contre cette maladie.
A suivre…
Date de dernière mise à jour : 05/05/2024
Ajouter un commentaire
