La course aux vaccins
Résumé tout public
Devant l’absence de médicament réellement efficace contre le SARS-CoV-2 et les conséquences de ses effets pathogènes, la vaccination constitue une solution pour combattre l’infection ou une résurgence de celle-ci dans le futur.
La vaccination est un traitement prophylactique qui consiste à stimuler le système immunitaire avec un agent infectieux (par exemple un virus inactivé) ou un de ses composants (par exemple une de ses protéines) de telle sorte qu'aucun dommage ou maladie ne soit causé. Ainsi, lorsque l'hôte sera confronté à cet agent infectieux, le système immunitaire pourra le neutraliser de manière efficace avant qu'il ne provoque un quelconque effet néfaste.
Historiquement, la vaccination a été pratiquée selon l'une des deux approches suivantes (OMS) :
- introduction d'antigènes spécifiques (par exemple des protéines virales) contre lesquels le système immunitaire réagit directement,
- introduction d'agents infectieux vivants atténués (par exemple des virus) qui se répliquent chez l'hôte sans provoquer de maladie et qui synthétisent les antigènes activant le système immunitaire.
Du fait des nombreuses pandémies et infections apparues au cours du siècle dernier avec les virus du SIDA, des hépatites B et C, de Zika, d'Ebola, du papilloma, de la grippe H1N1, du SARS-CoV-1, du MERS-CoV, etc.) de nouvelles stratégies de vaccination ont été développées grâce aux avancées récentes en biologie moléculaire et cellulaire, en génomique et bio-informatique.
Aujourd'hui, de nouvelles plateformes vaccinales sont en cours d'essai clinique ou à l'étude en pré-clinique, et tout particulièrement depuis Mars 2020, lorsqu'est apparue la pandémie du COVID-19.
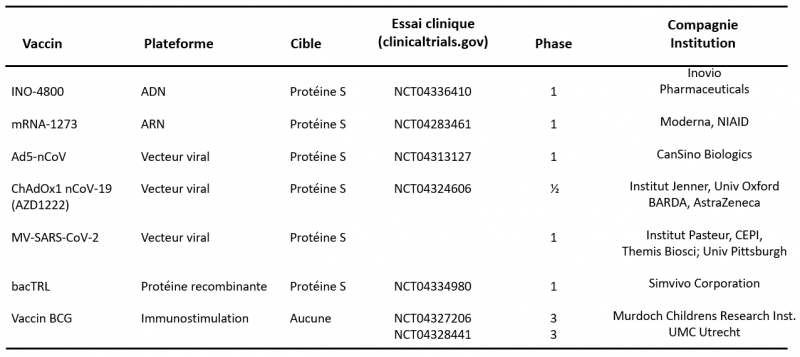
Il ne s’agit pas ici de donner une vue exhaustive sur toutes les stratégies utilisées pour développer un vaccin. Je vais simplement me limiter aux approches susceptibles de conduire à un vaccin anti-SARS-CoV-2 dans les années 2020-2021. Dans la grande majorité des cas, l’antigène viral ciblé par les candidats vaccins est la protéine S (Spike) du SARS-CoV-2. En effet, cette protéine joue un rôle central dans l’entrée du virus dans les cellules et il est anticipé qu’une forte liaison des anticorps sur cette protéine inhiberait le processus d’infection.
Les candidats vaccins dont le développement est le plus avancé aujourd'hui (fin Juin 2020)
Pour cela, il faut être capable d'introduire cette protéine virale S dans le corps des personnes à vacciner de la façon la plus efficace possible pour pousser le système immunitaire à fabriquer des lymphocytes T dont le but sera de tuer les cellules infectées par le virus et des lymphocytes B qui produiront des anticorps neutralisants contre ce virus. Comme indiqué sur le tableau ci-dessus, diverses stratégies sont utilisées à cet effet: vaccins à ADN, vaccins à ARN messager, vaccins utilisant des vecteurs viraux (adénovirus, virus de la rougeole), vaccins basés sur la protéine virale S du SARS-CoV-2. On compte aujourd’hui (fin Juin 2020) plus de 130 projets de développement de vaccins contre le SARS-CoV-2, dont approximativement 46% sont développés en Amérique du Nord, 36% en Asie et Australie et 18% en Europe.
La course aux vaccins
Devant l’absence de molécule réellement efficace contre le SARS-CoV-2 (voir ce site "La course aux traitements") et les conséquences de ses effets pathogènes (voir sur ce site "Comment meurt-on du Covid-19 ?"), la vaccination constitue une solution pour combattre l’infection ou une résurgence de celle-ci dans le futur.
La vaccination consiste à stimuler le système immunitaire avec un agent infectieux, ou des composants d'un agent infectieux, modifiés de telle sorte qu'aucun dommage ou maladie ne soit causé. Ainsi, lorsque l'hôte sera confronté à cet agent infectieux, le système immunitaire pourra le neutraliser de manière adéquate avant qu'il ne provoque un quelconque effet néfaste. Depuis plus de cent ans, la vaccination est pratiquée selon l'une des deux approches suivantes (OMS) :
- introduction d'antigènes spécifiques contre lesquels le système immunitaire réagit directement,
- introduction d'agents infectieux vivants atténués qui se répliquent chez l'hôte sans provoquer de maladie et qui synthétisent les antigènes activant le système immunitaire.
Développement de vaccins
Les stratégies développées contre les coronavirus SARS-CoV-1 et MERS-CoV fournissent une voie toute tracée pour le développement et la mise au point de vaccins contre le SARS-CoV-2. Ainsi, beaucoup de ces stratégies étaient centrées sur la protéine virale S (Spike), et ont été testées de manière extensive en pré-clinique (Zhou et al., Vaccines 2018). Bien que de multiples candidats vaccins contre le SARS-CoV-1 et le MERS-CoV aient été évalués dans le cadre d'essais sur l'homme, aucune avancée au-delà des études de sécurité de la phase 1 n’a été enregistrée. De même, aucun vaccin n'a été développé contre d'autres coronavirus humains.
Dans les mois qui suivirent les premières publications sur le génome du SARS-CoV-2, de nombreux travaux furent lancés sur divers candidats vaccins, basés sur les enseignements tirés du SARS-CoV-1 et du MERS-CoV, en particulier aux niveaux de la sécurité chez l’homme et des antigènes viraux. On compte aujourd’hui (fin Juin 2020) plus de 130 projets de développement de vaccins contre le SARS-CoV-2, dont approximativement 46% sont développés en Amérique du Nord, 36% en Asie et Australie et 18% en Europe.
Les diverses plateformes vaccinales
Historiquement, le développement d’un vaccin requiert environ 10 ans avec 6% de probabilité de mise sur le marché (Pronker et al. Plos One 2013). Une accélération (5 ans) a été observée récemment avec le vaccin contre Ebola. Dans le cas du SARS-CoV-2, la mobilisation mondiale, la mise en place de financements importants, les nouvelles technologies (plateformes de vaccins à ADN, RNA et virus recombinants) font entrevoir la possibilité de mise sur le marché de vaccins dès 2021.
Plusieurs vaccins décrits ci-dessous, sont entrés en phase 1 d’essai clinique sur de petites nombres de sujets pour évaluer leur sécurité d’utilisation, leur devenir dans l'organisme, le seuil de tolérance, les effets indésirables, les doses et fréquence d'administration. Etant donné l'absence de modèle animal préclinique de la maladie du COVID-19, la plupart des essais sur ces vaccins seront réalisés directement chez l'homme (Diamond et al., Cell Host & Microbes 2020 ; Thanh et al., Nature 2020 ; Pardi et al., Nature Review Drug Discovery 2018).
Il ne s’agit pas ici de donner une vue exhaustive sur toutes les stratégies utilisées pour développer un vaccin. Je vais simplement me limiter aux plateformes vaccinales qui, du fait de leur avancement et/ou de leurs avantages, sont susceptibles de conduire à un vaccin anti-SARS-CoV-2 dans les années 2020-2021 (Graham, Science 2020).
Dans la grande majorité des cas, l’antigène viral ciblé par les candidats vaccins est la protéine S (Skype) du SARS-CoV-2. Comme déjà discuté sur ce site (voir sur ce site : "Entrée du virus dans les cellules") cette protéine joue un rôle central dans l’entrée du virus dans les cellules et il est anticipé qu’une forte liaison des anticorps sur cette protéine inhiberait le processus d’infection.
Cellules dendritiques, cellules présentatrices d’antigènes et immunité adaptative
Comme nous l’avons vu sur ce site (voir sur ce site : "Comment meurt-on du Covid-19 ?"), l’immunité adaptative se met en place à la suite de l’immunité innée. Les cellules dendritiques, qui sont des cellules présentatrices d'antigènes du système immunitaire des mammifères, agissent comme messagers entre l'immunité innée et l'immunité adaptative. Les autres cellules présentatrices d’antigènes sont les macrophages et les cellules B.
Les cellules dendritiques sont présentes dans les tissus (milieu interstitiel) qui sont en contact avec l'environnement extérieur, comme la peau (où il y a une type de cellule dendritique spécialisée appelée cellule de Langerhans) et la paroi interne du nez, des poumons, de l'estomac et de l’intestin. Elles peuvent se trouver également dans la lymphe et le sang. A certains stades de leur développement, elles produisent des projections ramifiées, les dendrites, d’où leur nom. Bien que d'apparence similaire, ces dendrites sont des structures distinctes des dendrites neuronales. Les cellules dendritiques jouent un rôle central dans la mise en place de la réponse immunitaire adaptative. Pour cela et en d’autres termes, elles sont capables de faire le tri entre les cellules du soi et les cellules ou biomolécules étrangères à l’organisme (le pathogène et ses antigènes).
Les cellules dendritiques immatures (non activées, avant une rencontre avec un antigène) patrouillent constamment dans leur milieu environnant, liquide interstitiel et lymphe, à la recherche d’agents pathogènes tels que les virus et les bactéries. Ces cellules phagocytent ces agents pathogènes et dégradent leurs protéines en peptides qui sont transportés à leur surface par les Complexes Majeurs d’Histocompatibilité CMH-I et CMH-II. Elles sont alors activées en cellules dendritiques dites « matures » et migrent vers les ganglions lymphatiques et la rate où elles interagissent avec les cellules T (cytotoxiques) et les cellules B (productrices d’anticorps) pour initier et modeler la réponse immunitaire adaptative spécifique et durable contre le pathogène considéré. Simultanément, elles régulent à la hausse les récepteurs à la surface cellulaire qui participent à l'activation des cellules T et des cellules B.
Les lymphocytes T cytotoxiques (CTL) et les lymphocytes B producteurs d’anticorps jouent un rôle majeur dans la réponse immunitaire adaptative. A côté de leur production de cytokines spécifiques, ces cellules expriment à leur surface des récepteurs T cellulaires (TCR) ou B cellulaires (BCR) capables de reconnaître les antigènes spécifiques des pathogènes. Cette propriété remarquable de pouvoir reconnaître une multitude de peptides différents est la conséquence de recombinaisons génétiques qui ont lieu entre les gènes qui codent pour ces divers récepteurs durant la maturation de ces cellules dans la moelle osseuse (lymphocytes B) ou dans le thymus (lymphocytes T). L’organisme produit des centaines de milliers de types différents de cellules T et B, et chaque type exprime sur sa membrane un récepteur TCR ou BCR spécifique, qui se liera à un antigène spécifique ; à chaque instant des millions de cellules T et B circulent dans le sang et la lymphe.
Les CTL porteurs du corécepteur CD8 sont activés par interaction avec le CMH-I des cellules dendritiques, alors que les CTL porteurs du corécepteur CD4 sont activés par interaction avec le CMH-II. Le rôle des CTL est de tuer les cellules infectées par le pathogène (immunité dite cellulaire) par le processus apoptose (mort cellulaire programmée). Certaines populations des cellules T (les CTL-CD4+, dits « helpers ») servent également à la prolifération d’autres cellules du système immunitaire, en particulier les lymphocytes B, cellules productrices d’anticorps (immunité dite humorale).
Les lymphocytes B sont activés dans la lymphe, les ganglions lymphatiques ou la rate après rencontre avec un antigène spécifique via leur BCR. Ils peuvent également être activés et entrer en prolifération en réponse aux cytokines émises par les CTL-CD4+ (lymphocytes T helpers).
Quelle que soit la plateforme vaccinale utilisée, il est donc essentiel de cibler les cellules dendritiques et les autres cellules présentatrices d’antigènes (macrophages et cellules B, notamment).
Vaccin à ADN : INO-4800
La vaccination par ADN consiste à administrer à la personne à traiter un fragment d’ADN codant pour un antigène (une protéine) spécifique d’un agent pathogène (bactérie, virus, parasite, etc). Dans le cas de la vaccination contre le COVID-19, l’antigène le plus utilisé est la protéine S du SARS-CoV-2. Cette technique sous-entend que l’ADN administré va pénétrer dans les cellules et la machinerie cellulaire va produire la protéine en question, entraînant ainsi une réponse immunologique protectrice contre une infection ultérieure par le pathogène considéré.
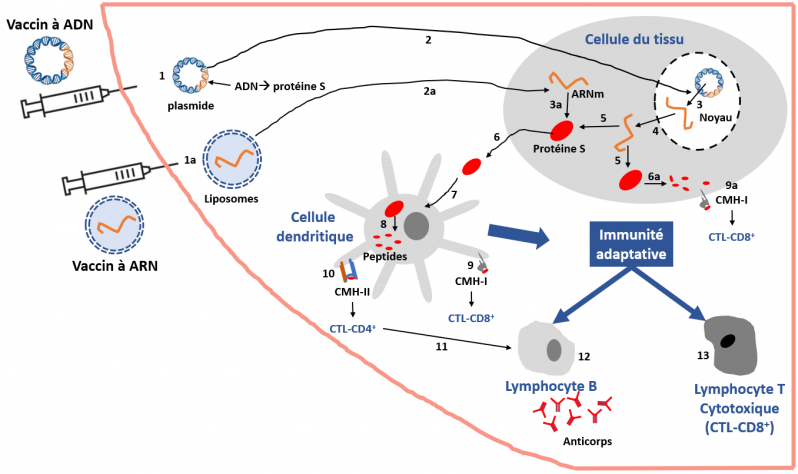
Vaccins à ADN ou à ARN messager (schéma simplifié).
Comment ça marche ?
Vaccin à ADN (plasmide contenant la séquence d’ADN codant pour la protéine antigénique, par exemple la protéine S du SARS-CoV-2) 1, est administré par voie intramusculaire, intradermique ou sous-cutanée. 2. Passage du plasmide dans les cellules du tissu (kératinocytes, myocytes, autres) ou les cellules du système immunitaire présentatrices d’antigènes (cellules dendritiques, macrophages, cellules B) présentes sur le site de l’injection ou dans son voisinage (dans un souci de simplification, cette dernière possibilité n’est pas montrée sur la figure). 3. L’ADN passe dans le noyau des cellules où il est transcrit en ARN messager (ARNm) puis, 4. l’ARNm passe dans le cytoplasme où 5., il est traduit en protéine (ellipses rouges) par les ribosomes cellulaires. 6. Les cellules excrètent la protéine antigénique - non reconnue comme partie du soi - dans le milieu extracellulaire et celle-ci peut être captée par les cellules dendritiques, 7 (les autres cellules présentatrices d’antigènes ne sont pas montrées ici mais participent également). 8. La protéine antigénique est dégradée en petits peptides qui sont transportés à la surface des cellules via les complexe majeurs d’histocompatibilité CMH-I ou CMH-II, 9 ou 10, respectivement. Une autre alternative est que les cellules du tissu dégradent la protéine antigénique en petits peptides 6a qui sont soient excrétés (non montré), soient transportés à la surface des cellules via le complexe majeur d’histocompatibilité de type I, 9a (le CMH-II n’est pas exprimé dans les cellules non présentatrices d’antigènes). Après activation, les cellules dendritiques migrent dans les ganglions lymphatiques, et présentent l’antigène (fragment/peptide de la protéine S) via les molécules du CMH-I et CMH-II aux lymphocytes T cytotoxiques-CD8+ ou -CD4+, respectivement, qui expriment les récepteurs spécifiques reconnaissant ces peptides. Les lymphocytes T-CD4+ activent la différenciation et la prolifération des lymphocytes B, producteurs d’anticorps spécifiquement dirigés contre la protéine antigénique en question.
Vaccin à ARNm (le plus souvent des liposomes-nanoparticules lipidiques- contenant l’ARN messager codant pour la protéine antigénique, par exemple la protéine S du SARS-CoV-2) 1a, est administré par voie intramusculaire, intradermique ou sous-cutanée. 2a. Les liposomes entrent dans les cellules et relarguent l’ARNm qu’ils contiennent. 3a. Cet ARNm est traduit en protéine antigénique. La suite des évènements est alors la même que celle décrite ci-dessus.
Les vaccins à ADN présentent des avantages potentiels par rapport aux vaccins classiques : stabilité biologique et chimique, facilité de fabrication à grande échelle, coût faible, longue durée d’expression de l’antigène dans les cellules, absence de tout agent infectieux, administration répétée possible. De plus ces vaccins ont la capacité d’induire une large gamme de réponses immunitaires par les cellules B et T. Cependant, ils présentent aussi des désavantages et risques : possibilité de déclencher une maladie auto-immune contre l’ADN, et risque oncogénique selon l’endroit où l’ADN du vaccin pourrait s’intégrer dans le génome des cellules de l’hôte.
Un autre problème majeur est la façon d’administrer le vaccin. Idéalement, les vaccins à ADN doivent cibler les cellules dendritiques et autres cellules présentatrices d’antigènes. Les vaccins à ADN se sont avérés faiblement immunogènes chez l'homme lorsqu'ils sont administrés par voie intramusculaire, en raison de leur faible absorption par les cellules entraînant une production insuffisante d'antigène et une mauvaise stimulation du système immunitaire. L'électroporation intramusculaire (une technique qui consiste à appliquer de brèves impulsions électriques au tissu musculaire afin d’augmenter la perméabilité membranaire des cellules) permet de surmonter ce problème, en augmentant potentiellement l'immunogénicité de 10 à 1000 fois par rapport aux injections intramusculaires classiques.
Plusieurs vaccins à ADN sont disponibles pour un usage vétérinaire. A partir de 2016 des candidats vaccins à ADN contre le virus Zika (antigène : une protéine de l’enveloppe virale) ont été testés sur des modèles animaux, souris (Grubor-Bauk et al. Sci Adv 2019 ; Pires Amaral et al. Vaccine 2020) et macaques (van Rompay et al. Sci Transl Med 2019) avec des résultats très encourageants. Divers vaccins à ADN sont également en cours de développement préclinique et clinique contre le virus du SIDA (HIV) et contre le virus du Papillome (HPV).
Les vaccins à ADN sont produits par génie génétique. Ils se présentent le plus souvent sous la forme de plasmides (ADN circulaire bactérien), la séquence d’ADN d’intérêt qui code pour l’antigène de l’agent pathogène étant intégrée dans le plasmide. Ces vaccins à ADN sont un développement récent en médecine et pourraient éventuellement à terme remplacer les vaccins de première et deuxième génération.
INO-4800 est un candidat vaccin à ADN codant pour la protéine S du SRAS-CoV-2, en cours de développement par Inovio Pharmaceuticals (déposé sous le code NCT04336410 clinicaltrials.gov). Une approche similaire a été évaluée dans le cadre d'essais précliniques et cliniques d’un vaccin contre le MERS-CoV et dont l'immunogénicité a été démontrée (GLS-5300 ; code NCT02670187 clinicaltrials.gov). Trois doses de GLS-5300 ont permis la production d’anticorps liant la protéine virale S dans une majorité (94%) des personnes traitées et de lymphocytes T cytotoxiques spécifiques. Cependant, les anticorps neutralisants n’ont été observés que chez seulement 50% de ces personnes et les titres ont fortement diminué au cours des études de suivi (Modjarrad et al., Lancet Infectious Diseases 2019). C’est sur la base de ces expériences qu’est développé le candidat vaccin INO-4800, actuellement en cours d'évaluation dans un essai clinique ouvert de phase 1 (code NCT04336410 clinicaltrials.gov). Les personnes volontaires recevront deux doses d'ADN administré par voie intradermique par électroporation à 28 jours d'intervalle.
Vaccin à ARN : mRNA-1273
Selon le dogme de la biologie moléculaire, l’ADN est transcrit en ARN messager (copie du brin codant) au sein du noyau des cellules. Cet ARN messager sort ensuite du noyau et est traduit en protéine par les ribosomes au sein du cytoplasme des cellules.
A l’instar de la vaccination par ADN, la vaccination par ARN messager consiste donc à administrer à la personne à traiter un ARN codant pour un antigène (une protéine) spécifique d’un agent pathogène (bactérie, virus, parasite, etc.). Dans le cas de la vaccination contre le COVID-19, l’antigène est la protéine S du SARS-CoV-2. Cette technique sous-entend que l’ARN administré va pénétrer dans les cellules et sera traduit par les ribosomes pour produire la protéine en question, entraînant ainsi une réponse immunologique protectrice contre une infection ultérieure par le pathogène considéré.
Contrairement à l’ADN, l’ARN est extrêmement fragile car il est la cible des RNases, enzymes qui dégradent les ARN dans l’organisme, et doit donc être protégé lors de l’administration. En général cette protection est assurée par des nanoparticules lipidiques au sein desquelles l’ARN a été encapsulé. Des vecteurs viraux, virus à ARN, peuvent également être utilisés pour ce type de vaccination.
L’avantage des vaccins à ARN par rapport aux vaccins à ADN est le fait que l’ARN administré, quelle que soit sa forme, n’a pas à aller dans le noyau des cellules pour être efficace. Il est traduit directement dans le cytoplasme des cellules, ce qui facilite grandement le processus.
Actuellement, il n'existe aucun vaccin à ARN approuvé pour l'usage humain. Les vaccins à ARN offrent de multiples avantages sur les vaccins à ADN en termes de production, d'administration et de sécurité, et il a été démontré sur des modèles animaux qu'ils sont des candidats potentiellement intéressants pour des essais cliniques chez l’homme. Plusieurs entreprises, dont CureVac et Moderna, travaillent à la mise au point de vaccins à ARN messager, et un certain nombre de vaccins à ARN sont en cours de développement pour lutter contre la pandémie de COVID-19.
Les vaccins à ARN sont basés sur des ARN messagers spécifiquement modifiés et optimisés pour produire la protéine qu’ils codent en grande quantité et pour des durée prolongées. Cette technologie a été utilisée avec succès contre le virus de l’Influenza (Berlanda-Scorza et al. Vaccines 2018) et dans des études précliniques contre le virus Zika (Poveda et al. Vaccines 2019).
ARNm-1273 est un ARN messager modifié, encapsulé dans des nanoparticules lipidiques exprimant la protéine S du SARS-CoV-2 développé par le National Institut des allergies et des maladies infectieuses (NIAID) en collaboration avec la firme américaine Moderna. La conception de l'antigène, la protéine S codé par l'ARNm-1273, a été rendue possible par les études antérieures sur la stabilisation des protéines de fusion de classe I de MERS-CoV et autres coronavirus (Pallesen et al., PNAS 2017), et sa structure tri-dimensionnelle a été résolue en microscopie électronique (Wrapp et al. Science 2020). Un essai clinique de phase 1 de l'ARNm-1273 (code NCT04283461 clinicaltrials.gov) a été initié en mars 2020, dans une étude ouverte sur 45 sujets à qui le vaccin a été administré en deux doses à 29 jours d'intervalle. Les sujets seront suivis pendant les 12 mois suivant la deuxième dose pour évaluer la toxicité potentielle du vaccin, avec l'immunogénicité générée comme élément critère secondaire d’évaluation.
BNT162b1 est un candidat vaccin à ARN développé par BioNtech, Mainz Allemagne et Pfizer, Hurley, Royaume Uni. L’ARN codant pour le domaine de liaison au récepteur de la protéine S (Skype) du SARS-CoV-2 est formulé dans des nanoparticules lipidiques et administré par voie intramusculaire. Voir les premiers résultats obtenus avec ce vaccin ICI.
Vaccins à base de vecteurs viraux
Les virus recombinants au sein desquels on peut intégrer par manipulation génétique des fragments du génome relatifs à d’autres virus, constituent un type de vecteur extrêmement performant. En effet, ces virus présentent en général une capacité d’infection importante (ce qui est recherché pour avoir une bonne réponse immunologique) et, de surcroît, peuvent être choisis de façon à cibler un tissu particulier du fait de leur tropisme biologique. Parmi les vecteurs viraux les plus utilisés en préclinique et en clinique, on trouve les adénovirus, les rétrovirus, les lentivirus et le virus de la rougeole.
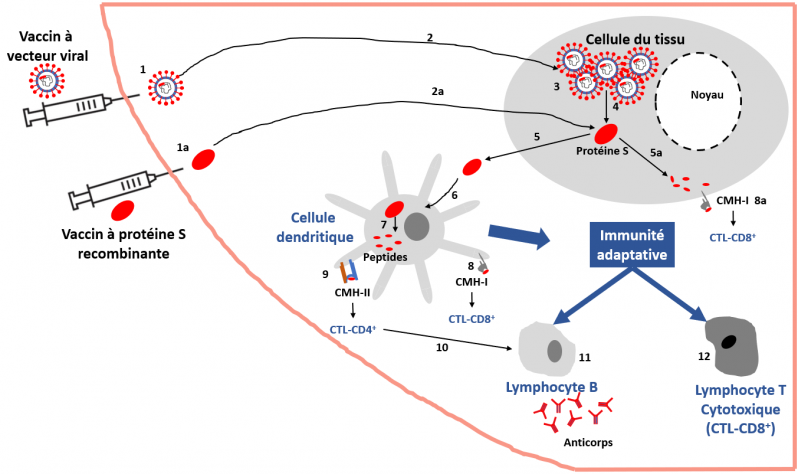
Vaccins à base de vecteurs viraux ou de protéine recombinante (schéma simplifié).
Comment ça marche ?
Vaccin à base de vecteur viral est un virus recombinant inactivé, utilisé comme moyen de transport d’un antigène dans le tissu. 1. Les divers types de virus utilisés à cet effet (voir texte) ne sont pas détaillés ici, ce schéma étant identique quelle que soit la nature du virus. Le génome de ce virus (ADN ou ARN selon le virus) a été modifié de façon à ce qu’il contienne la séquence nucléotidique (ADN ou ARN) codant pour la protéine antigénique (trait rouge), par exemple la protéine S du SARS-CoV-2. 2. Le vaccin est administré par voie intramusculaire, intradermique ou sous-cutanée et passe dans les cellules du tissu (kératinocytes, myocytes, autres) ou les cellules du système immunitaire présentatrices d’antigènes (cellules dendritiques, macrophages, cellules B) présentes sur le site de l’injection ou dans son voisinage (par souci de simplification, cette dernière possibilité n’est pas montrée sur la figure mais elle existe). Noter que le vaccin peut également être administré par d’autres voies selon l’organe cible (nébulisation nasale par exemple pour cibler le système respiratoire). 3. Le virus entre et prolifère dans les cellules. 4. Au cours des étapes de prolifération, la protéine antigénique est produite. 5. Les cellules excrètent la protéine antigénique dans le milieu extracellulaire et celle-ci peut être captée par les cellules dendritiques, 6 (les autres cellules présentatrices d’antigènes ne sont pas montrées ici mais participent également). 7. La protéine antigénique est dégradée en petits peptides qui sont transportés à la surface des cellules via les complexe majeurs d’histocompatibilité CMH-I ou CMH-II, 8 ou 9, respectivement. Une autre alternative est que les cellules du tissu dégradent la protéine antigénique en petits peptides 5a qui sont soient excrétés (non montré) soient transportés à la surface des cellules via le complexe majeur d’histocompatibilité de type I, 8a (le CMH-II n’est pas exprimé dans les cellules non présentatrices d’antigènes). Après activation, les cellules dendritiques migrent dans les ganglions lymphatiques, et présentent l’antigène (fragment/peptide de la protéine S) via les molécules du CMH-I et CMH-II aux lymphocytes T cytotoxiques-CD8+ ou -CD4+, respectivement, qui expriment les récepteurs spécifiques reconnaissant ces peptides. Les lymphocytes T-CD4+ activent la différenciation et la prolifération des lymphocytes B, producteurs d’anticorps spécifiquement dirigés contre la protéine en question.
Vaccin à protéine recombinante. 1a. La protéine antigénique, par exemple la protéine S du SARS-CoV-2, est produite par génie génétique, purifiée et utilisée comme vaccin. 2a. Elle est administrée par voie intramusculaire, intradermique ou sous-cutanée et entre dans les cellules. La suite des évènements est alors la même que celle décrite ci-dessus.
Adénovirus humain, Ad5-nCoV
Les adénovirus constituent une famille de virus à ADN en double brin linéaire qui regroupe une centaine de variétés, dont une quarantaine environ peut infecter l'être humain. La majorité des sérotypes d'adénovirus humains n'entraînent que des signes cliniques bénins. Ils se répliquent dans le noyau des cellules infectées et peuvent transduire des segments d'ADN de plusieurs milliers de paires de bases. Les sérotypes humains Ad2 et Ad5 sont bien caractérisés génétiquement et biochimiquement, ce qui rend aisée leur manipulation. Les adénovirus recombinants peuvent se multiplier sans réarrangement ou perte de matériel génétique. Cette absence de réarrangement les différencie notoirement des rétrovirus qui font l'objet de nombreuses modifications au cours de la réplication, et en particulier l’insertion de tout ou partie de leur génome dans les chromosomes de l’hôte. Les adénovirus n'insèrent pas leur génome dans les chromosomes (Chasse et al. Médecine/Sciences 1989).
De multiples vaccins à base d’adénovirus ont été développés en préclinique contre le SRAS-CoV-1 et le MERS-CoV. Ces vaccins ont induit des réponses humorales et cellulaires et ont protégé divers modèles animaux contre les infections. Un vaccin utilisant l'adénovirus 5 humain exprimant la protéine S du SARS-CoV-2 (Zhu et al. Lancet 2020) est actuellement testé par l'Institut de Biotechnologie de Pékin et CanSino Biologics Inc., (code NCT04313127 clinicaltrials.gov).
Adénovirus de Chimpanzé, AZD1222
Le ChAdOx1 nCoV-19, aujourd'hui connu sous le nom d'AZD1222, est un vaccin contre le SARS-CoV-2 qui a été développé par l'Institut Jenner de l'Université d'Oxford, en collaboration avec l'Oxford Vaccine Group (Dicks et al. Plos One 2012). Il utilise un vecteur adénoviral de chimpanzé non réplicatif (protéine E1 absente) qui exprime la protéine virale S du SARS-CoV-2 responsable de la liaison du virus sur la surface des cellules humaines. Cet adénovirus est basé sur une version affaiblie d'un virus du rhume (adénovirus) qui provoque des infections chez les chimpanzés. Après la vaccination, la protéine virale S du SARS-CoV-2 est produite, ce qui permet au système immunitaire de mettre en place une réponse adaptative au SARS-CoV-2. Une étude publiée récemment montre que ce vaccin est efficace sur le singe rhésus macaque. Une injection unique de ChAdOx1 nCoV-19 induit une réponse immune humorale et cellulaire qui conduit à une absence d’infection chez les primates soumis à une infection par le SARS-CoV-2, sans effet secondaire (van Doremalen et al. MedRxiv 2020). L’intérêt d’utiliser un adénovirus de Chimpanzé est que l’espèce humaine n’exprime pas d’anticorps contre cet adénovirus, ce qui garantit son efficacité.
Le vecteur adénovirus recombinant (ChAdOx1) a été choisi pour générer une forte réponse immunitaire à partir d'une seule dose et il ne se réplique pas, donc ne peut pas provoquer une infection continue chez l'individu vacciné. Les vaccins fabriqués à partir du virus ChAdOx1 ont été administrés à plus de 320 personnes à ce jour et se sont avérés sûrs et bien tolérés, bien qu'ils puissent provoquer des effets secondaires temporaires tels qu'une température élevée, des symptômes de type grippal, des maux de tête ou un bras douloureux.
Ce projet (code NCT04324606 clinicaltrials.gov) est développé dans le cadre d’un consortium comprenant, l’Institut Jenner d’Oxford, l’Université d’Oxford, le BARDA (Biomedical Advanced Research and Development Authority), et AstraZeneca une société biopharmaceutique mondiale qui assurera la production de 400 millions de doses dans un premier temps et a une capacité d’un milliard de doses sur les années 2020-2021, si ce vaccin confirme les espoirs portés en lui.
Virus de la rougeole, MV-SARS-CoV-2
Le vaccin contre la rougeole est largement utilisé depuis plus de 40 ans, distribué dans le monde entier, et déjà administré à plus de 2 milliards d’enfants avec succès. Il confère une protection de 95% sans effet secondaire notable. En utilisant le virus de la rougeole comme vecteur pour construire de nouveaux vaccins contre d’autres pathogènes, on espère obtenir ces mêmes caractéristiques. Ce modèle de vaccin a montré une grande efficacité contre les virus apparentés SARS-CoV-1 (Escriou et al. Virology 2014) et MERS-CoV, dans des modèles animaux (Bodmer et al. Virology 2018 ; Malczyk et al. J Virol 2015) avec l’induction d’une immunité humorale et cellulaire et une réponse mémoire protectrice. D’autres candidats vaccins reposant sur ce modèle sont actuellement en développement clinique et ciblent les virus Zika (financement de l’Union Européenne) et Lassa (financé par le CEPI (Coalition for Epidemic Preparedness Innovations).
Dans cette approche, développée depuis plusieurs années par les chercheurs de l’Institut Pasteur, le virus de la rougeole (vivant, atténué et non pathogène) est utilisé comme vecteur d’antigène. Dans le cas présent, la séquence d’ARN codant pour la protéine S du SARS-CoV-2 a été intégrée dans le génome du virus de la rougeole. Ce vaccin porte le nom de MV-SARS-CoV-2. Un essai clinique de phase 1 doit démarrer en Septembre 2020. Consortium Institut Pasteur de Paris, Themis Bioscience GmbH (Themis) et Université de Pittsburgh/Center for Vaccine Research (CVR).
Vaccin à base de protéines virales recombinantes : BacTRL-Spike
Une protéine dite « recombinante » est une protéine produite par une cellule dont le matériel génétique a été modifié par recombinaison génétique. Un gène codant pour une protéine d'intérêt est introduit dans le génome de l'espèce productrice (bactéries, levures, cellules mammifères en culture, animaux transgéniques, etc.). Les protéines recombinantes peuvent ainsi être produites en grande quantité, purifiées et utilisées à des fins thérapeutiques, industrielles ou bien encore dans les activités de recherche, et notamment le développement de vaccins.
Les vaccins sous-unitaires à base de protéine de l’espèce pathogène représentent une stratégie de choix lorsque la protéine porte les épitopes protecteurs. Ce type de vaccin a été utilisé dans plateformes vaccinales pour le HBV (Virus de l’hépatite B) avec la protéine HBs (Shouval et al ; Med Microbiol Immunol 2015), le HIV (virus du SIDA) avec les protéines gp160 (Liao et al ; Curr Mol Med 2018), le HPV (virus du Papillome) avec la protéine L1 (Garbuglia et al ; Front Immunol 2020).
Un vaccin, bacTRL-Spike, a été récemment conçu pour délivrer des plasmides contenant de l'ADN synthétique codant pour la protéine S du SRAS-CoV-2. Il est issu de la plateforme technologique de Symvivo. Il s’agit d’une souche de bactéries probiotiques (Bifidiobacterium longum) génétiquement modifiée pour exprimer la protéine S. Ce vaccin est en cours de développement par la société Symvivo Corporation (NCT04334980 clinicaltrials.gov). Le protocole planifié constituera la première étude du bacTRL-Spike chez l'homme. Le vaccin sera administré par voie orale. Chaque dose orale de bacTRL-Spike contient un milieu bactérien avec soit 1 milliard (groupe 1A), 3 milliards (groupe 2A) ou 10 milliards (groupe 3A) d'unités formant des colonies de Bifidobacterium longum vivant. Le placebo sera constitué d'un milieu bactérien sans bactéries.
Vaccin immunostimulateur
De nombreuses études cliniques sont en cours pour explorer l'utilisation du Bacille Calmette-Guerin (BCG) comme vaccin immunostimulateur pour se protéger contre la maladie COVID-19. Le BCG est un isolat vivant et atténué de Mycobacterium bovis délivré sous forme de vaccin à faible coût à plus de 100 millions des enfants chaque année pour les protéger contre Mycobacterium tuberculosis. De multiples études sur les humains et les souris suggèrent que l'administration du BCG confère une effet protecteur contre les virus (Moorlag et al., Clin Microbiol Infect 2019). Les mécanismes de la protection croisée induite par le BCG pourraient venir des réponses de type Th1 (production d'interféron gamma et interleukine 2) et Th17 (production d'interleukine 17) aux antigènes hétérologues, et de l'induction d'une mémoire non spécifique d’antigène (ou "immunité entraînée") dans les cellules du système immunitaire inné capables de produire des cytokines lorsqu'elles sont activées par une infection virale.
Deux essais cliniques de phase 3 sont en cours. Un essai conduit par le Murdoch Childrens Research Institute (Melbourne, Australie) sur plus de 10 000 professionnel de santé (code NCT04327206 clinicaltrials.gov). Ces personnes seront randomisées et recevront soit une dose unique du vaccin BCG, soit une dose sérum physiologique comme placebo. Elles seront suivies au plan médical pendant un an (tests PCR COVID-19 sur le sang et par voie nasale, analyse sanguines etc.). L’autre essai est conduit par l’UMC de Utrecht (Utrecht, Pays Bas) et portera sur 1500 professionnels de santé selon un protocole proche de celui décrit ci-dessus (code NCT04328441 clinicaltrials.gov).
Modèles d'animaux
L'émergence et la diffusion rapide du SARS-CoV-2 a laissé une très courte période pour combler les lacunes en matière de connaissances sur l'immunité adaptative aux coronavirus. En effet, le principal problème réside dans l'absence de petits animaux modèles de la maladie pour faciliter la mise au point de vaccins candidats et l'étude détaillée de l'immunité adaptative. On sait que les souches de souris classiquement utilisées en laboratoire ne sont pas sensibles à l'infection par le SARS-CoV-2 car la protéine ACE2 murine ne peut agir comme récepteur cellulaire pour le SARS-CoV-2 du fait de sa séquence en acides aminés suffisamment différente de la séquence de la protéine humaine (Letko et al., 2020). Des souris transgéniques qui expriment l'ACE2 humain (hACE2-Tg) existent et développent une pneumonie après l'infection ; toutefois, ces souris sont très couteuses et non encore largement disponibles pour les tests de vaccination. Par ailleurs, la pathogenèse et les études d'évaluation de la réponse immunitaire dans différentes espèces de primates non humains ou d'autres modèles animaux possibles (par exemple, les furets et les hamsters) sont encore à un stade précoce de développement. De fait comme indiqué plus haut, la plupart des essais en cours sont réalisés directement chez l’homme, sans passage par des modèles précliniques.
Quels sont les risques liés à la vaccination ?
La sécurité est la considération première de tout programme de développement de vaccins, compte tenu de l'administration anticipée à un très grand nombre de personnes, par ailleurs en bonne santé. Au-delà des possibilités de réactogénicité (effets secondaires courants tels que douleurs, et fièvre), il existe deux types majeurs de risques liés à la vaccination : i) la facilitation (paradoxale) de l’infection par les anticorps, et ii) la maladie respiratoire aiguë associée à un vaccin.
Facilitation de l'infection par des anticorps
Des études sur divers virus, ainsi que sur les SARS-CoV-1 et MERS-CoV, ont soulevé des questions quant au fait que les réponses vaccinales pourraient, paradoxalement, potentialiser l'infection par un phénomène appelé en anglais « antibody-dependent enhancement » (ADE) ou en français, facilitation de l'infection par des anticorps. Il s’agit d’un phénomène dans lequel certaines cellules du système immunitaire comme les monocytes et/ou les macrophages qui possèdent à leur surface des «récepteurs Fc» lient la région terminale dite Fc (Fragment cristallisable) des anticorps sur lesquels le virus est fixé. Le virus peut alors utiliser cette voie (en plus de sa voie classique d’entrée, par exemple le récepteur ACE2 pour le SARS-CoV-2) pour entrer dans les cellules immunitaires et les infecter. Ce phénomène a été observé dans le cas du virus de la Dengue et peut se détecter in vitro sur des cellules possédant le récepteur Fc. Des expériences en culture cellulaire ont montré que l'entrée du SARS-CoV-1 et l'infection résultante sont facilitées par certains anticorps dirigés contre la protéine virale S, par le biais des récepteurs Fc (Wan et al., J Virol 2020). Cependant, aucun élément ne suggère que ce phénomène soit actif dans l’infection par le SARS-CoV-1 in vivo dans les modèles animaux. La survenue de ce phénomène serait d’autant plus probable que les anticorps seraient peu performants, c’est à dire insuffisamment neutralisants (présentant un affinité pour le virus trop faible), insuffisamment spécifiques, ou produits en trop faible quantité.
Maladie respiratoire aigüe associée à un vaccin
Un deuxième type de risque potentiel est l’émergence d’une maladie respiratoire aigüe associée au vaccin. Ce phénomène a été observé pour la première fois dans les années 1960 chez des enfants ayant reçu un vaccin contre le virus syncytial (VRS) inactivé par le formaldéhyde. L’aggravation de la maladie était caractérisée par une infiltration pulmonaire par des cellules du système immunitaire, mononucléaires, granulocytes éosinophiles, ainsi qu'une réponse immunitaire adaptative de type Th2, dans laquelle les lymphocytes T (helper) produisent toute une batterie de cytokines comme les interleukines, 4, 5, 6, 9, 10 et 13 (Ruckwardt et al., 2019). Ce processus de dépôt de complexe immunitaire après l’induction d’anticorps liants, mais non neutralisants, a été proposé comme explication probable de cette réponse. Alors que les études précliniques de plusieurs cas de SARS-CoV-1 montraient une protection contre l’infection, une réponse immunopathogène de type Th2 telle que celle décrite ci-dessus a également été observée dans certains cas (Bolles et al., 2011). La structure de l'immunogène, la formulation du vaccin, la nature de l’adjuvant, et l’âge du bénéficiaire du vaccin peuvent influencer cette réponse immunitaire biaisée. Dans presque tous les exemples de maladie respiratoire aigüe associée au vaccin observée chez l’humain pour le VRS et la rougeole, et chez les animaux pour le SARS, l'antigène du vaccin était le virus entier inactivé.
Sur la base des progrès récents obtenus dans le développement du vaccin contre le VRS, produire des anticorps neutralisants dirigés sur la protéine S, ainsi qu’une réponse immunitaire adaptative de type Th1 (production d’interféron gamma et d'interleukine-12) seraient un gage de sécurité dans le développement d’un vaccin contre le SARS-CoV-2.
Mesures à prendre pour éviter les risques liés à la vaccination
Il existe des moyens d'atténuer les risques de facilitation de l’infection et de maladie respiratoire associées à un vaccin contre le SARS-CoV-2 grâce aux expériences acquises sur les vaccins anti-dengue, anti-VRS et autres (Browne et al. Vaccine 2020). Il sera important de démontrer le potentiel d'efficacité du vaccin dans les études cliniques en phase précoce en mesurant l'induction d'anticorps neutralisants (anticorps présentant une affinité aussi élevée que possible pour la protéine virale antigène, ici la protéine S dans la majorité des cas) et dans des modèles animaux en démontrant la protection contre la réplication du virus et la maladie. Il sera tout aussi important de veiller à conserver la conformation naturelle des antigènes pour obtenir des résultats de haute qualité, l'anticorps pertinent sur le plan fonctionnel et éviter ainsi l'induction d'anticorps non neutralisants et les réponses immunitaires biaisées. L’utilisation de doses de dilutions variables du vaccin et l’examen attentif de la pathologie pulmonaire dans les modèles animaux lorsque cela sera possible devraient également aider à évaluer la probabilité d'une pathologie liée au vaccin lorsqu’il sera utilisé chez l’homme.
Conclusion
Le développement d'un vaccin viral efficace nécessite historiquement des décennies de la recherche fondamentale sur la biologie virale et la réaction de l'hôte à l'infection. Cette voie traditionnelle n'est pas réalisable pour un nouvel agent pathogène tel que le SARS-CoV-2 pour lequel un besoin impérieux de vaccin existe. Bien que les pratiques de confinement et les changements de comportement puissent endiguer efficacement la propagation de l’infection, une vaccination sera probablement nécessaire pour empêcher la mise en place de possibles vagues ultérieures.
Etant donné l’ampleur de l’effort consacré au développement de candidats vaccins au niveau mondial, il est raisonnable d’envisager la mise sur le marché de plusieurs vaccins dans l’année qui arrive. On peut légitimement se poser la question de savoir si ces vaccins anti-SARS-CoV-2 seront efficaces en cas de nouvelles émergences de cette famille de coronavirus dans le futur. Bien que ce virus ait un taux de mutation relativement faible par rapport à d’autres tels que le virus du SIDA ou le virus de l’hépatite C par exemple, il est possible que des variants génétiques différents du SARS-Cov-2 circulent et que les vaccins développés en 2020-2021 ne seront pas forcément optimaux pour des vagues futures. Mais il faut rappeler que c’est ce qui se passe avec le virus de la grippe saisonnière (HxNy). On peut donc imaginer qu’une fois que des candidats vaccins anti-SARS-CoV-2 auront été développés ils seront susceptibles d’être rapidement adaptés à des souches nouvelles de ce virus.
De fait, de nombreuses inconnues demeurent sur l'immunité innée et adaptative en réponse aux coronavirus. De plus, comme nous l’avons vu il existe des risques associés au développement de vaccins au cours d'une pandémie. Cependant, dans le cadre du rapport bénéfice/risque, ces incertitudes doivent être considérées vis-à-vis d’une part du coût économique énorme des mesures de confinement et d’autre part des mesures prises pour rendre ces risques aussi faibles que possible du fait de l’expérience acquise précédemment sur d’autres virus. Dans ce contexte, des études cliniques soigneusement conçues dans le but d’évaluer la sécurité et de définir la qualité et la durabilité de la protection, peuvent non seulement donner lieu à une contre-mesure efficace pour réduire et contrôler la pandémie, mais aussi fournir des mécanismes clés sur la réponse du système immunitaire adaptatif à l’infection par le SARS-CoV-2 et, éventuellement, les coronavirus hautement pathogènes apparentés qui pourraient émerger à l'avenir.
A suivre...
Date de dernière mise à jour : 30/11/2020
Commentaires
-

- 1. Céline Féger Le 14/01/2021
Bonjour,
je cherche un schéma simple pour faire comprendre à des non-scientifiques le fonctionnement du vaccin à ARNm. Une réticence importante est liée à la crainte que ce type de vaccin permette à du matériel génétique d'être incorporé dans le génome cellulaire. C'est pourquoi je trouve que votre schéma sur le mécanisme d'action du vaccin à ARNm serait parfait, et j'aurais aimé le propager, sauf qu'il combine les vaccin à ADN, ce qui risque d'alimenter cette confusion que je tâche de combattre à ma mesure ....
Que pensez-vous de séparer les deux schémas, pour éviter toute confusion ?
Bien à vous
Ajouter un commentaire